Activité 1 : Paléothermomètre isotopique
Introduction
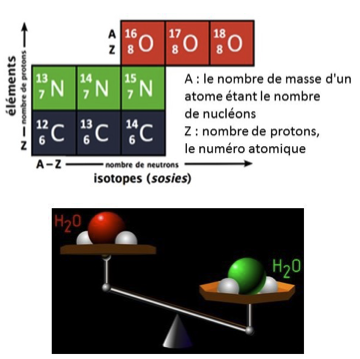
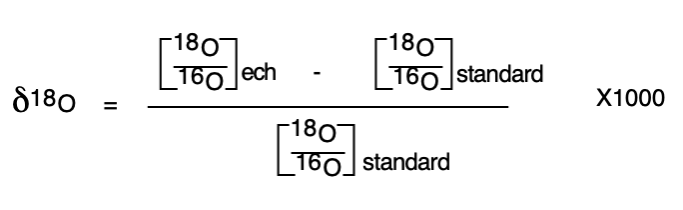
L’eau est constituée d’oxygène et d’hydrogène : l’un comme l’autre possèdent des isotopes stables qui peuvent être utilisés comme indicateurs de la température du milieu. Pour l’oxygène, 16O est l’isotope le plus fréquent (99,8%) de l’oxygène dans la nature et 18O est plus rare (0,2%). Comme il possède 2 protons supplémentaires, il est plus lourd. Il existe donc des molécules d’eau légères H16O et d’eau lourde H18O. Ces deux molécules n’auront pas le même comportement au cours du cycle de l’eau. L’eau légère s’évapore plus facilement que l’eau lourde qui, elle, se condense plus facilement. Il se produit alors un fractionnement isotopique. Un spectromètre de masse permet d’analyser le rapport 18O/16O des molécules d’eau dans un échantillon. Il peut être comparé au rapport 18O/16O d’un échantillon standard de référence nommé SMOW (Standard Mean Ocean Water) représentant la composition isotopique moyenne de l’eau terrestre. Le standard a été créé en 1967 par le mélange d’eaux distillées en provenance d’eaux océaniques recueillies en différents points du globe. Son rapport isotopique est de 1/500e. Le taux (en ‰) de différence par rapport au standard, nommé δ18O, est calculé selon la formule suivante :
Actuellement : ceaux océaniques = 0, MAIS δ18O glaces de surface ≠ 0 (pouvant aller jusqu’à-55 ‰)
Problème : Comment expliquer les différences de rapport isotopiques par rapport au standard ? Quel lien peut-on faire avec la température ?Quelles informations sur le climat terrestre passé nous apporte le δ18O ?
Objectifs :
- Comprendre les rapports isotopiques de l’oxygène dans leurs relations avec l’eau
- Utiliser le δ18O dans la détermination des climats passés
- Comprendre les mécanismes influençant les réchauffements ou refroidissements climatiques
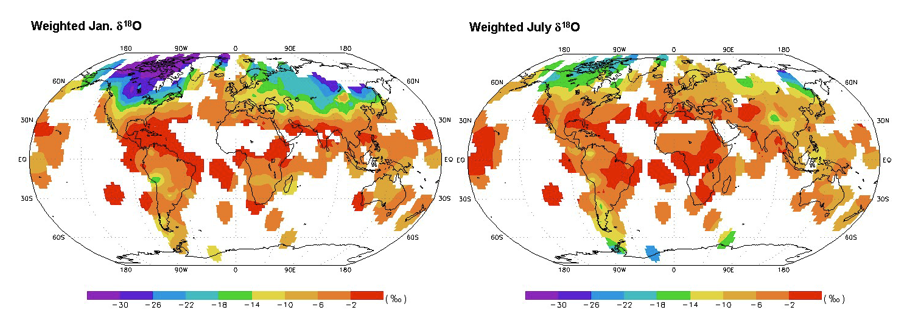
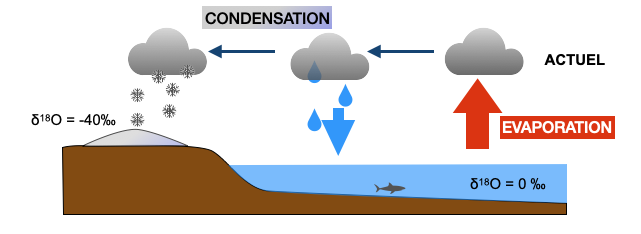
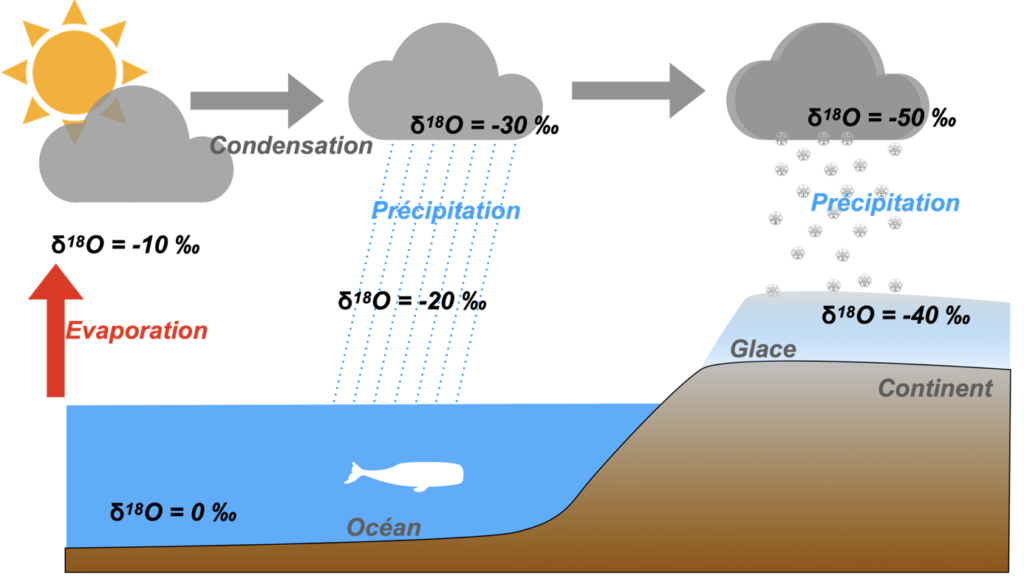
1) A l’aide des documents 1 et 2, expliquez les différences de δ18O mesurées entre les eaux océaniques (δ18O=0) et les eaux de précipitations au niveau des calottes glaciaires (δ18O= -40 ‰). Aidez-vous du schéma de référence.
Document 1 : Les mesures actuelles des météorologistes de δ18O dans les précipitations
Les molécules d’eau s’évaporent essentiellement aux basses latitudes (zone intertropicale). Les nuages qui en résultent sont portés par les circulations atmosphériques vers les plus hautes latitudes (N et S) et durant ce trajet, des précipitations se produisent sous forme de pluie ou de glaces. Les calottes de glace se forment par l’accumulation et la compaction de la neige au niveau des pôles. Lorsqu’il neige (ou pleut), les météorologistes réalisent au même moment des mesures de δ18O dans les précipitations et des mesures de température des nuages. Ces mesures, en un même lieu, ont été réalisées à diverses températures (été, hiver,…).
Les cartes ci-dessous sont extraites du site de l’université de Waterloo et ont été établies à partir de données recueillies de 1961 à 1999 par 389 stations GNIP (Global Network for Isotopes in Precipitation).
Moyenne mensuelle du δ18O des eaux de précipitation aux mois de janvier et juillet :
Document 2 : Relation entre δ18O et température
Les mesures réalisées dans les glaces du Groenland ont permis la construction de ce graphique et ont permis d’établir une loi entre δ18O et température qui se vérifie par les mesures réalisées.
Cette relation est liée au fractionnement isotopique entre l’oxygène lourd 18O et l’oxygène léger 16O au moment de l’évaporation et de la condensation de la vapeur d’eau en pluie ou en glace.
Schéma de référence :
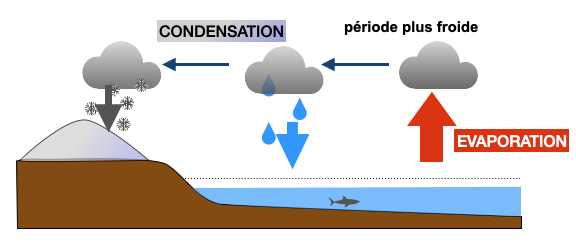
Situation à compléter en cas de refroidissement par rapport à l’actuel :
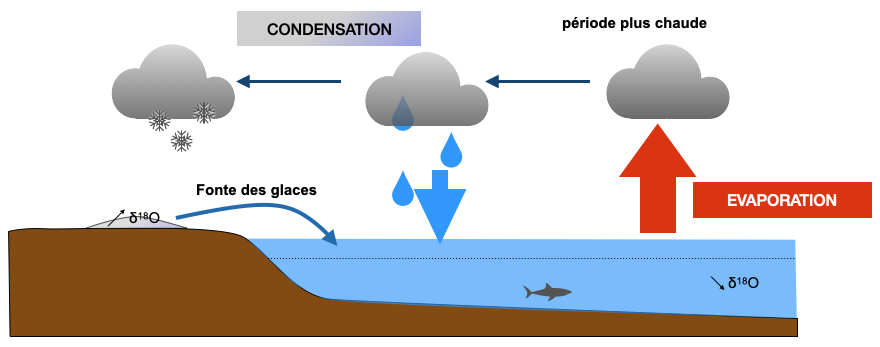
Situation à compléter en cas de réchauffement par rapport à l’actuel :
2) Pour l’époque actuelle, quel isotope est favorisé dans les différents mécanismes à l’origine du δ18O et son évolution (augmentation ou diminution).
3) A l’aide du document 2, indiquez le rapport entre δ18O et température. Déterminez le plus précisément possible l’équation de la droite δ 18O=f(T) avec T=température.
4) En période plus froide, il y a moins d’évaporation à l’équateur et l’eau lourde aura d’autant plus de mal à s’évaporer. En période chaude, il y a plus d’évaporation à l’équateur et l’eau lourde aura plus de facilité à s’évaporer également. A partir de cette relation, indiquez l’évolution du δ18O des glaces et de l’océan en période plus chaude de l’actuel ou plus froide que l’actuel en complétant le schéma précédent.
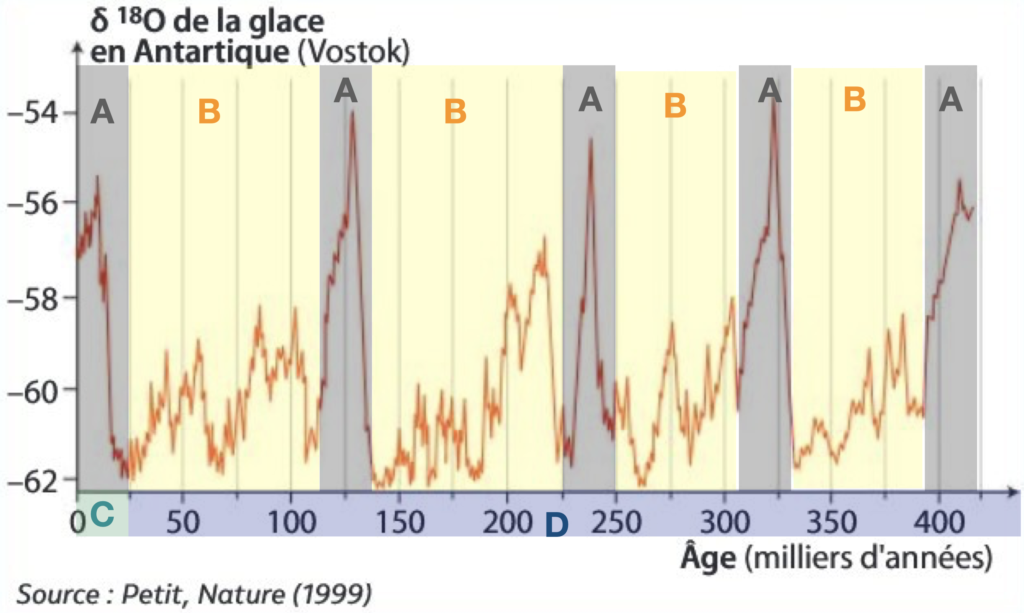
5) A l’aide du document 3 ci-après et de la relation entre δ18O et température, déterminez la température minimale et maximalerelevée.
6) Indiquez l’évolution de la température dans les dernières centaines de milliers d’années.
7) Indiquez sur les graphiques les périodes froides (glaciaires) et plus chaudes (interglaciaires).
8) Datez l’installation de la période postglaciaire nommée Holocène (la période précédente est nommée Pléistocène).
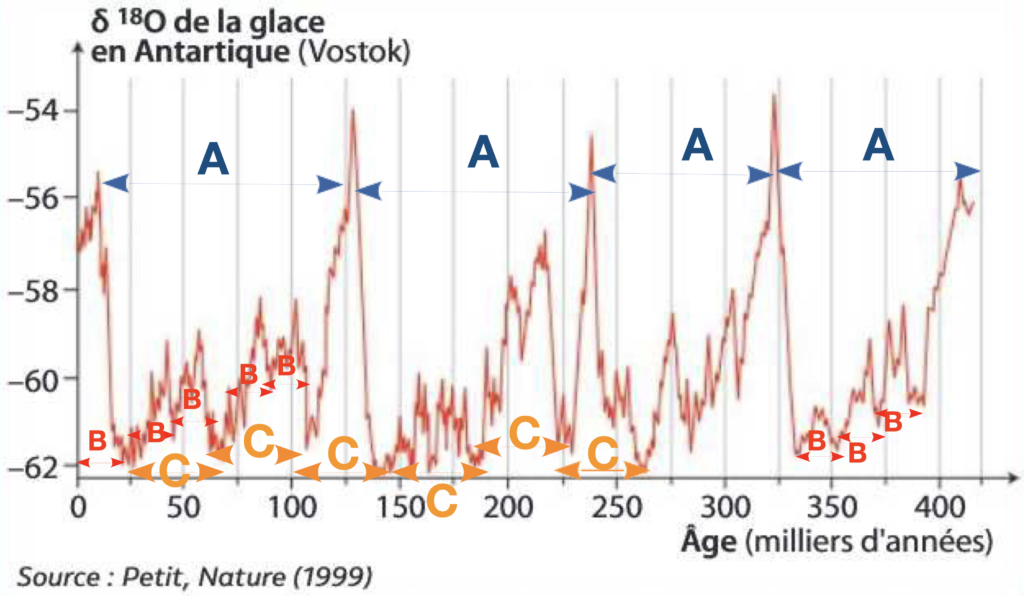
Document 3 : Le δ18O des glaces polaires.
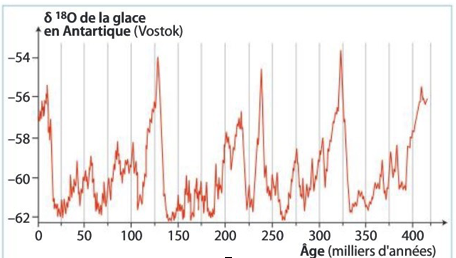

Les traces des climats passés sont piégées dans les profondeurs des glaces polaires du Groenland et de l’antarctique. Les chercheurs étudient la composition de leurs molécules d’eau (ainsi que les bulles d’air pour la concentration en CO2 atmosphérique) qu’elles renferment. Des forages de plus de 3 600m de profondeur permettent de récolter des échantillons de glace de 420000 ans au Groenland et 800000 ans (Dôme C) en Antarctique.
Une carotte de glace à Variation du δ18O dans les glaces antarctiques depuis 400 000 ans
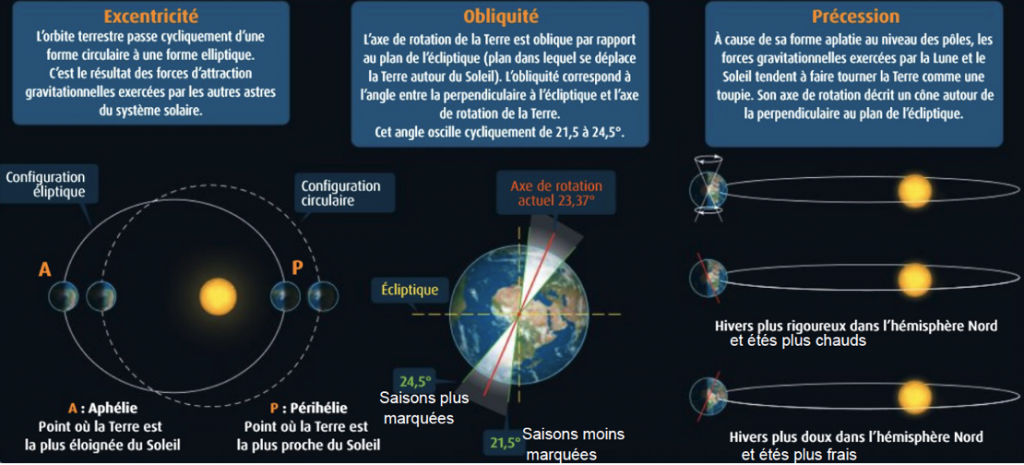
9) A l’aide du document 4 et du document 3, repérezles différentes variations des périodes climatiques sur les enregistrements de δ18O que vous raccorderez aux paramètres astronomiques de Milankovitch.
Document 4 : Le δ18O des glaces polaires. L’origine des variations climatiques du quaternaire (Pléistocène- Holocène)
Visionner la vidéo L’Esprit Sorcier : Les paramètres de Milankovitch
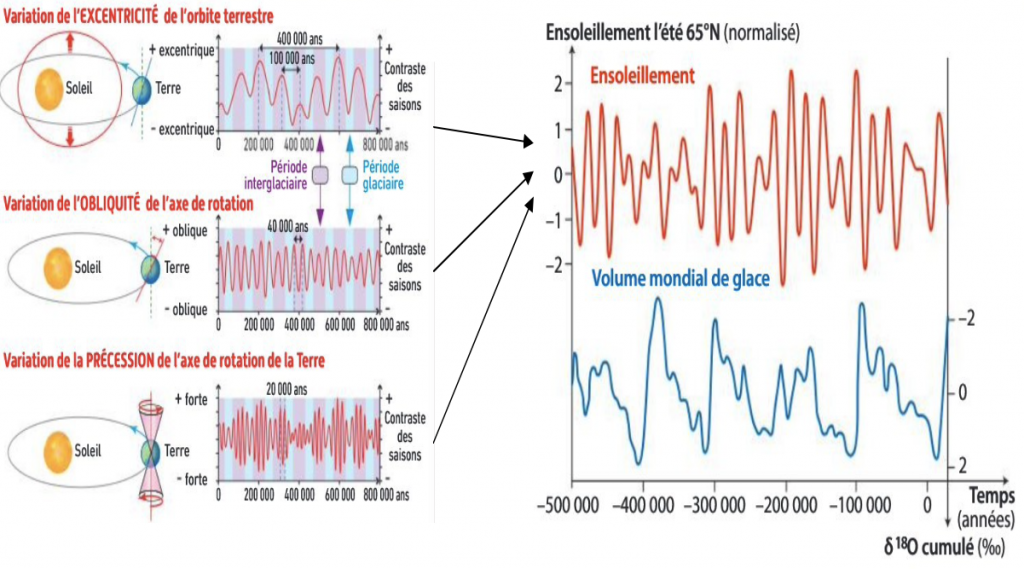
Incidences des paramètres orbitaux sur le contraste des saisons et les variations calculées de l’insolation étivale dans les hautes latitudes (65°N) comparé au volume mondial des glaciers:
10) Qu’en déduisez-vous sur l’origine des variations de températures du Quaternaire?
Document 5 : phénomènes amplificateurs
En comparant l’insolation reçue (à 65°N) selon ces paramètres et le volume des glaces, nous retrouvons la périodicité mais nous n’observons pas une corrélation directe en ce qui concerne les intensités. Nous observons des phases d’intenses changements (entrée ou sortie de glaciation) puis des variations plus modestes. Les vitesses de ces changements laissent penser que des phénomènes amplifient les changements climatiques initiés par les paramètres orbitaux.
Teneur en CO2 de l’atmosphère et écart de température.
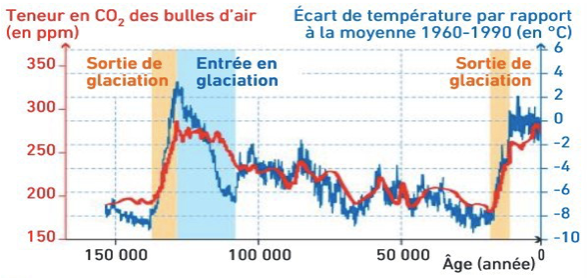
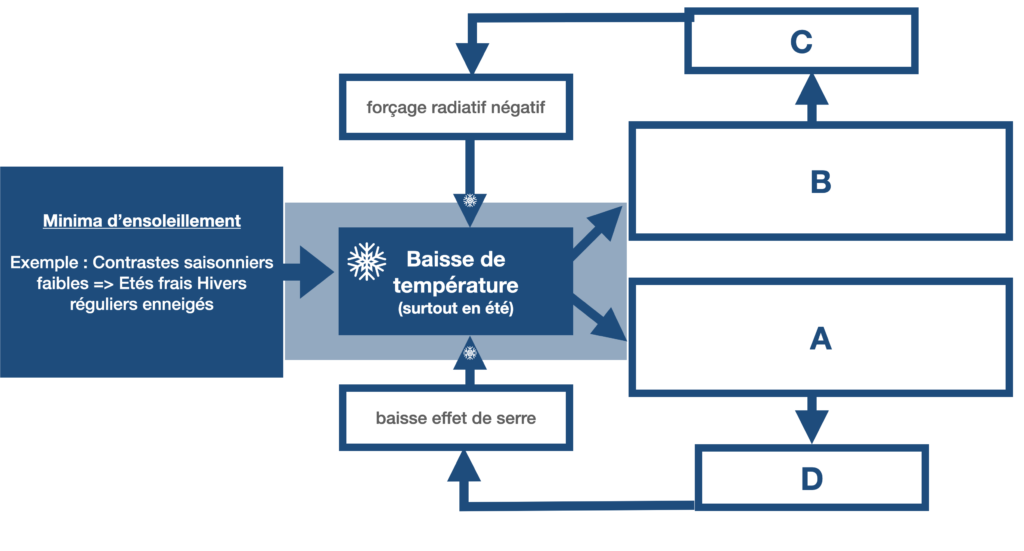
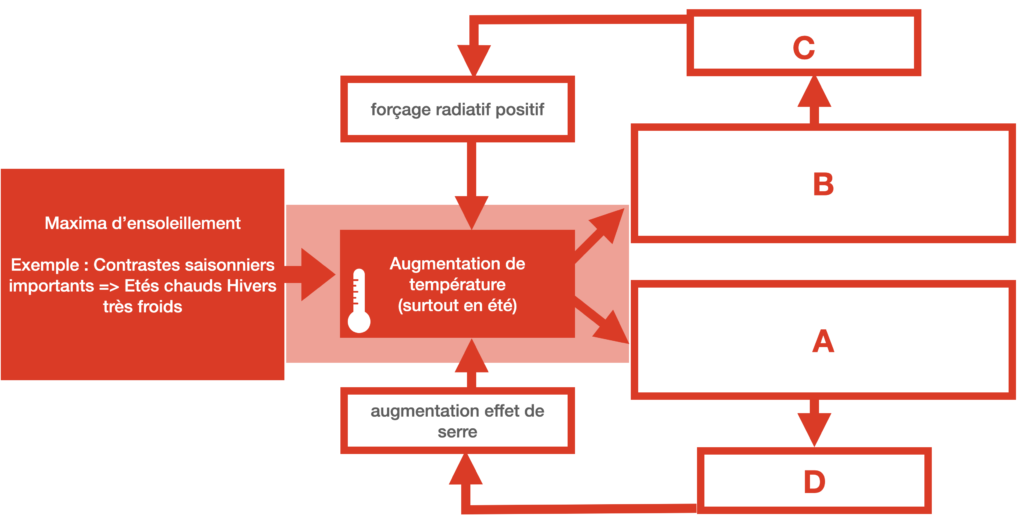
11) A l’aide de l’ensemble de documents ci-dessous, expliquez simplement l’entrée et la sortie de glaciation par deux schémas, en partant de l’incidence solaire due aux paramètres orbitaux favorables ou non et en présentant les rétroactions provoquées par l’albédo et la dissolution du CO2 dans les océans.
=> Lien avec l’enseignement scientifique
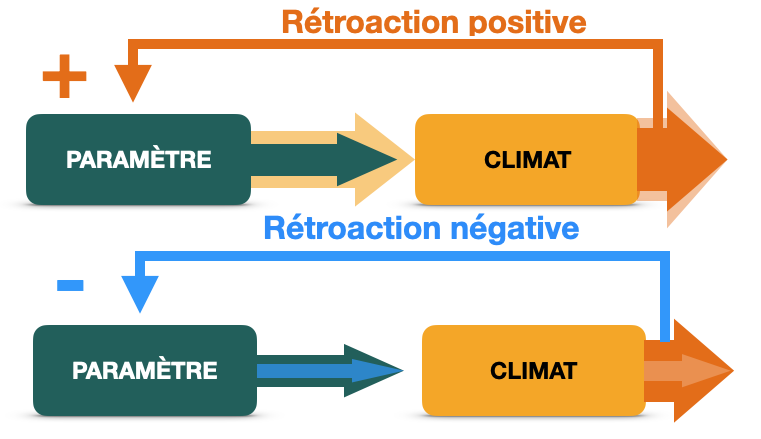
Document 6 : Les contrastes saisonniers et l’entrée en glaciation
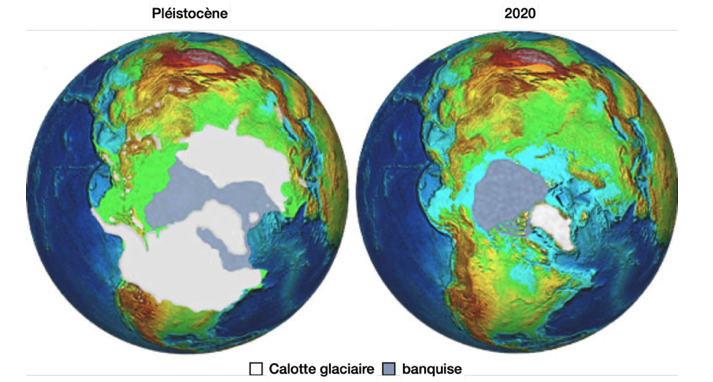
Les faibles contrastes entre été et hiver (été frais – hiver doux), sont favorables à l’entrée en glaciation, essentiellement dans l’hémisphère nord où il y a plus de masses continentales favorables à l’accumulation de précipitations neigeuses. En effet, lorsque les étés sont plus frais, les neiges et glaces d’hiver fondent plus difficilement et ne disparaissent pas totalement. Il se produit alors une accumulation de glaces au cours des hivers successifs.
A l’inverse, les forts contrastes saisonniers favorisent la sortie de glaciation car les étés très chauds ont tendance à faire fondre la glace d’hiver.
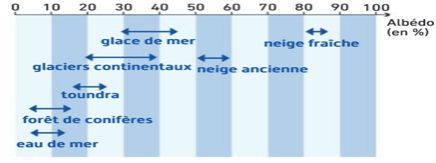
L’albédo est le % du rayonnement solaire incident réfléchi par la surface terrestre (pouvoir de réflexion d’un corps)
Document 7 : La solubilité du CO2 dans les océans
L’albédo est le % du rayonnement solaire incident réfléchi par la surface terrestre (pouvoir de réflexion d’un corps)
Dégazage
CO2 (gazeux) + H2O ⇋ HCO3 + H (dissout)
Dissolution
| Température (°C) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Solubilité (g.L-1) | 3,35 | 2,32 | 1,68 | 1,26 | 0,97 | 0,76 | 0,57 | 0,43 | 0,25 | 0,08 | 0 |
Documents pour le QCM pronote
Question 2
Question 7
Question 8
Question 10
Question 11
Pour aller plus loin : Activité proposée par l’ENS Lyon

