Introduction : L’une des maladies génétiques parmi les plus fréquentes est la mucoviscidose. Son étude permet de mieux comprendre sa transmission et les espoirs futurs. D’autres anomalies peuvent aussi survenir, comme par exemple des anomalies de caryotypes.
Problème : Comment est transmise la mucoviscidose ? Quelles sont les techniques de dépistage et comment expliquer les symptômes ?
Objectifs :
- Comprendre la première maladie génétique en France
- Connaître quelques techniques d’analyse génétique ou de diagnostic anté-natal
- Comprendre les anomalies de caryotypes
I- La mucoviscidose
Doc. 1 : du génotype au phénotype : la mucoviscidose

D’après Nathan Spécialité SVT terminale
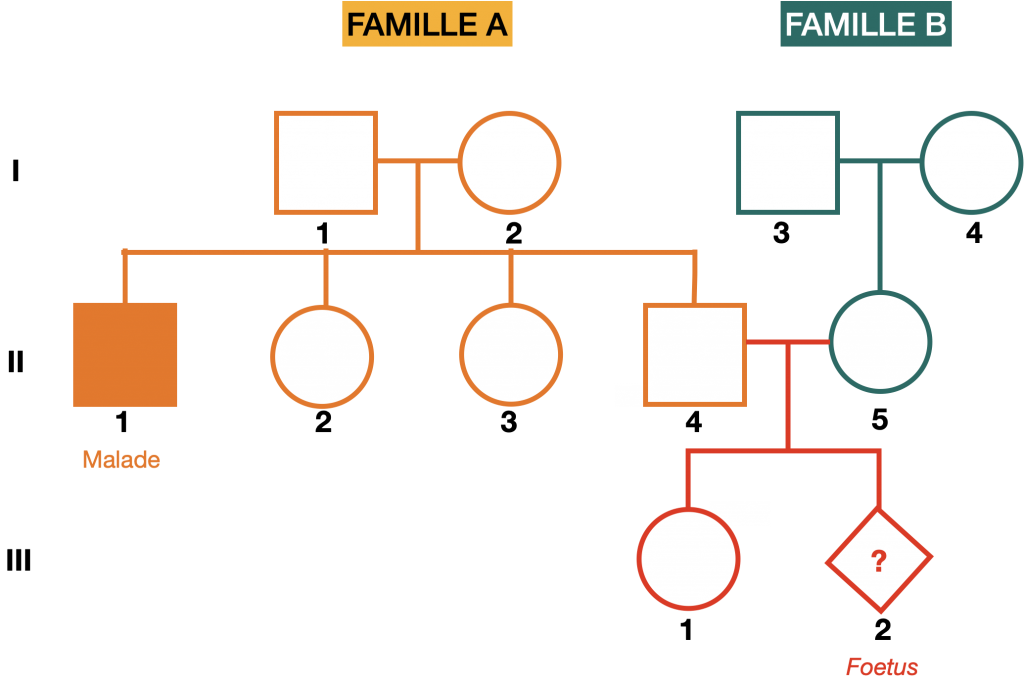
Doc.2 : Analyse généalogique et risques
La mucoviscidose est la maladie génétique la plus fréquente dans les pays occidentaux.
Chaque année, 200 enfants naissent en France avec la mucoviscidose, ce qui représente environ une naissance sur 4500. Il existe cependant de fortes disparités régionales : en Bretagne la fréquence est plus élevée (1 naissance sur 3000) et on estime qu’une personne sur 27 environ est hétérozygote.
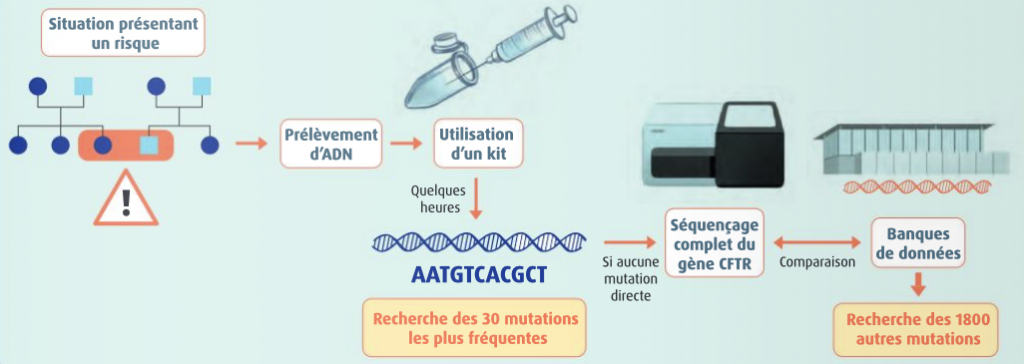
Une consultation de conseil génétique permettra, après une analyse généalogique, d’évaluer un risque de maladie génétique et d’orienter éventuellement vers des tests génétiques plus précis.
1- Analyser la transmission de cette maladie dans ces 2 familles bretonnes afin d’établir le mode de transmission de la maladie et de déterminer le risque que le père et la mère soit hétérozygotes et que le fœtus soit malade.
2- A l’aide du document 1 proposer une méthode de diagnostic plus précise adaptée à la situation.

Activité :
3- A l’aide d’Anagène et des données issues du séquençage des allèles des 4 membres de la famille Famille-CFTR.edi (père II.4, mère II.5 et foetus III.2 et fille III.1), déterminer le génotype des 4 individus et la nature des allèles qu’ils portent ainsi que leur fréquence dans la population (document 3).
4- Préciser les risques pour le fœtus d’être malade.
5- A l’aide des docs 4 et 5, déterminez comment se fait le dépistage de la mucoviscidose en France
Doc. 3 : La banque de données « CFTR France »
La formidable progression des techniques de biologie moléculaire permet désormais d’accéder au génome individuel et de constituer puis de mettre à disposition des chercheurs, des banques de données sur les gènes ciblés. La banque de données « CFTR France » contient les données issues de 5151 malades et des 852 mutations différentes du gène CFTR dont ils sont porteurs (Il y a plus de 2000 mutations différentes du gène CFTR dans le monde). Cette banque associe à chaque allèle, les troubles qu’il provoque car les différents allèles n‘ont pas tous des conséquences aussi sévères. Ils sont classés en 5 catégories ( I et II : sévères, II, IV et V : peu sévères).
| Code allèle | Fréquence | Effets |
| F508del | 69,74 | Mucoviscidose |
| G542X | 2,54 | Mucoviscidose |
| G551D | 2,1 | Mucoviscidose |
| N1303K | 1,58 | Mucoviscidose |
| R117H | 1,31 | Variés |
| W128X | 1,22 | Mucoviscidose |
| 621 + G->T | 0,93 | Mucoviscidose |
| R553X | 0,93 | Mucoviscidose |
| 1717 G->A | 0,86 | Mucoviscidose |
| 3849 + 10kbC->T | 0,82 | Mucoviscidose |
| R1162X | 0,46 | Mucoviscidose |
| D1152H | 0,4 | Variés |
Doc. 4 : Dépistage
Depuis 2002, le dépistage généralisé de la mucoviscidose à la naissance a été mis en place. Le dépistage néonatal systématique permet la prise en charge du nouveau-né dans un centre de soins spécialisé dès le diagnostic et la mise en route d’un traitement précoce.
Le test consiste en une prise de sang au niveau du talon. Il est réalisé au troisième jour de la vie. Le sang prélevé permet le dosage d’une enzyme fabriquée par le pancréas (la trypsine immunoréactive ou TIR).
Si le taux de TIR est élevé, une analyse génétique (recherche des mutations du gène CFTR) est demandée.
En présence d’une ou deux mutations du gène, un test à la sueur est réalisé.
En l’absence de mutation génétique (ou en cas de refus de l’analyse génétique par les parents) et si le dosage de la trypsine est élevé au troisième jour, un dosage de l’enzyme est répété trois semaines plus tard. Si le taux reste élevé, un test à la sueur est réalisé.
D’après ameli.fr
Doc. 5 : Diagnostic prénatal et diagnostic pré-implantatoire
Le diagnostic prénatal de la mucoviscidose consiste à prélever du liquide amniotique ou des cellules du placenta dans l’utérus de la femme enceinte, afin de réaliser une analyse génétique de l’embryon. Il peut être proposé aux femmes enceintes :
- en début de grossesse, après un conseil génétique ;
- après une échographie détectant une anomalie du transit intestinal (obstruction).
Le prélèvement des cellules n’est pas un geste anodin. Dans 1 % des cas, une fausse couche survient dans la semaine qui suit le prélèvement.
Si le diagnostic prénatal montre que l’enfant souffre de mucoviscidose, les parents peuvent demander une interruption médicalisée de la grossesse.
Un diagnostic pré-implantatoirede la mucoviscidose peut être réalisé en cas de fécondation in vitro et après conseil génétique. Il consiste à réaliser une analyse génétique de cellules embryonnaires pour sélectionner un embryon non malade à implanter dans l’utérus de la future mère.
D’après ameli.fr et Belin Spécialité SVT
Doc. 6 :Le test de la sueur
Il constitue l’examen de confirmation diagnostique de référence. Les progrès de la génétique ne l’ont pas remis en question.
L’anomalie fonctionnelle de la protéine CFTR se traduit en effet au niveau de la glande sudoripare par un syndrome de perte de sel, principe de cet examen biologique. On dose les chlorures sudoraux dans la sueur recueillie après stimulation galvanique indolore au niveau de l’avant-bras ou de la cuisse chez le jeune nourrisson.
La sueur contient normalement moins de 30 mmol/L de chlorure. Le test est pathologique si la valeur mesurée est supérieure à 60 mmol/L. Le diagnostic de mucoviscidose est affirmé après 2 examens positifs.
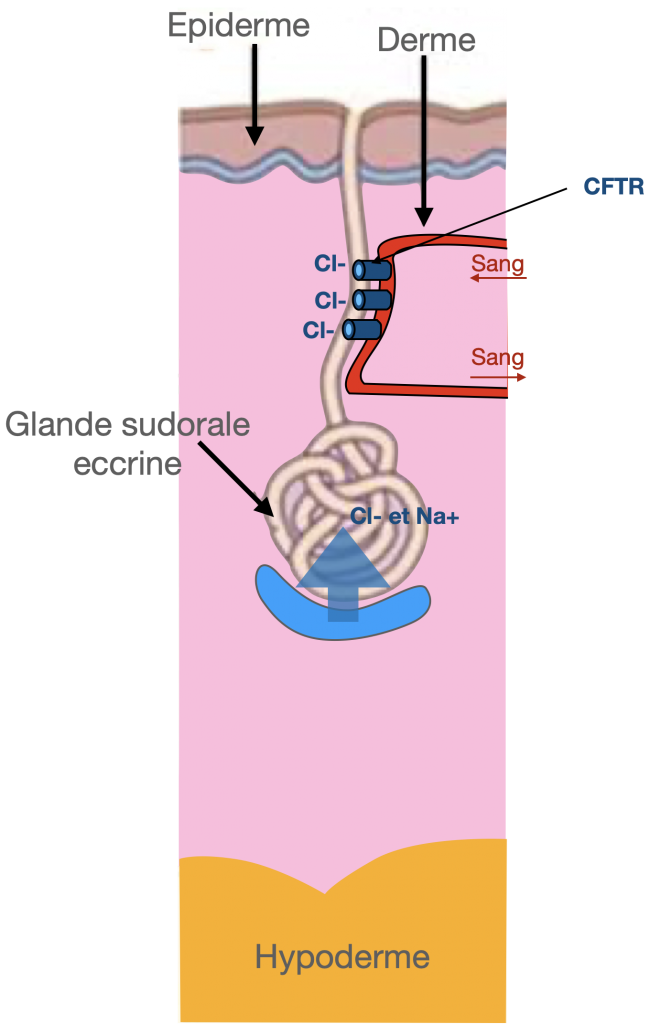
En cas de valeurs intermédiaires (30–59 mmol/L), il faut répéter ultérieurement le test, s’aider des examens de biologie moléculaire, voire réaliser des mesures électrophysiologiques du transport des ions chlorures en centre spécialisé (mesures de différence de potentiel nasal, courant de court-circuit sur biopsie rectale).
D’après campus.cerimes.fr
Compléments : Les tests génétiques actuels
Ces tests consistent à rechercher des anomalies sur la molécule d’ADN elle-même, ou à dépister des anomalies concernant le nombre ou la forme des chromosomes. Ils reposent sur l’étude du patrimoine génétique d’une personne, le plus souvent à partir d’une prise de sang. Ils peuvent être réalisés avant la naissance (test prénatal) ou après, à n’importe quel âge (test postnatal).
Ces tests sont envisagés dans trois situations :
- Le diagnostic de maladies génétiques : Un test génétique diagnostic est effectué en cas de symptôme pouvant évoquer une maladie génétique chez des enfants et des adultes, mais également chez des fœtus. (Il est désormais possible d’analyser des fragments d’ADN fœtal présents dans le sang de la mère et récoltés à partir d’une simple prise de sang chez cette dernière). Des tests génétiques peuvent également être effectués chez des personnes ne présentant aucun symptôme, mais ayant un risque d’être porteurs d’une mutation associée à une maladie grave et désirant concevoir un enfant. Le résultat du test permet alors d’évaluer le risque de transmettre la maladie à sa descendance.
- Le diagnostic préimplantatoire : Un couple susceptible de transmettre une maladie génétique grave et incurable à sa descendance peut demander un test génétique préimplantatoire. Ce test consiste à rechercher l’anomalie génétique dans le génome d’embryons conçus par fécondation in vitro, avant implantation dans l’utérus de la mère.
- Les tests de génétique somatique (non héréditaire) consistent à analyser le génome des cellules cancéreuses pour détecter des mutations survenues spécifiquement dans la tumeur et prédire la réponse à un traitement ciblé.
Il existe différents types d’analyses du génome : la génétique moléculaire (analyser la molécule d’ADN pour détecter des mutations) et la cytogénétique (étudier du nombre et de la forme des chromosomes).
Le caryotype = consiste à observer l’ensemble des chromosomes constituant le patrimoine génétique d’un individu. Une étape de culture des cellules est nécessaire (2 à 3 semaines) de manière à ce que les chromosomes puissent être observés au microscope au moment où ils se divisent. C’est le seul moment où ils sont visibles. On pourra ainsi les classer par paire, et en vérifier le nombre, la forme et la structure.
L’analyse par FISH (Fluorescent In Situ Hybridation)= permet de rendre fluorescente la zone du (ou des) chromosome(s) que l’on veut visionner au microscope. Elle est donc proposée lorsque les signes cliniques orientent l’examen génétique vers un chromosome précis.
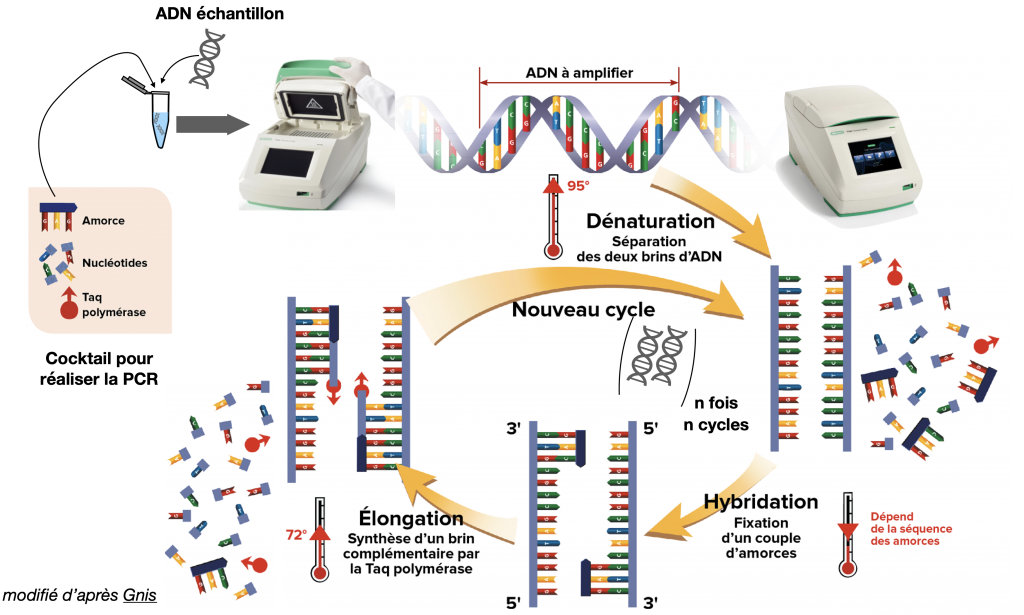
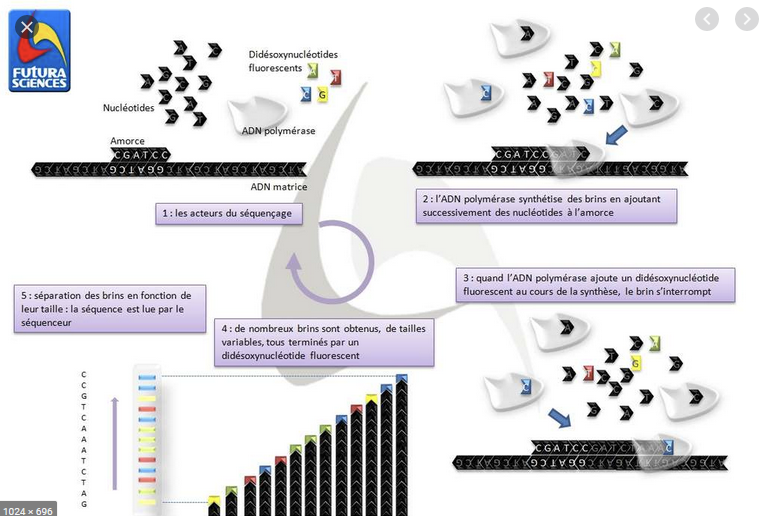
Séquençage de gènes = lecture des bases de l’ADN pour repérer une erreur (mutation). Une étape préalable d’amplification (reproduction du fragment d’ADN en plusieurs millions de copies identiques par PCR (Polymerase Chain Reaction) est nécessaire pour que le séquenceur puisse lire le gène.
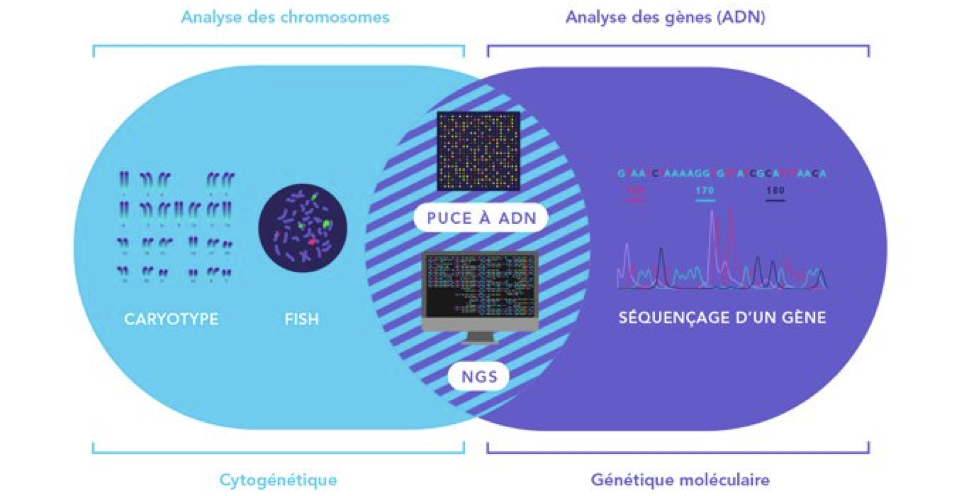
Les puce à ADN = associe l’aspect global du caryotype et la haute résolution de l’hybridation ciblée de la génétique moléculaire. Le principe est la comparaison de l’ADN du patient à de l’ADN standard. Cela permet de voir s’il y a une augmentation ou une diminution anormale du matériel génétique
Les NSG (nouvelles générations de séquenceurs) permettent cette lecture de manière beaucoup plus rapide et sont parfois utilisés, non pas pour « lire » l’ADN, mais pour permettre de compter le nombre de chromosomes.
Précisions sur la technique d’amplification de l’ADN : la PCR
Précisions sur la technique de séquençage dite Sanger
Résultats :
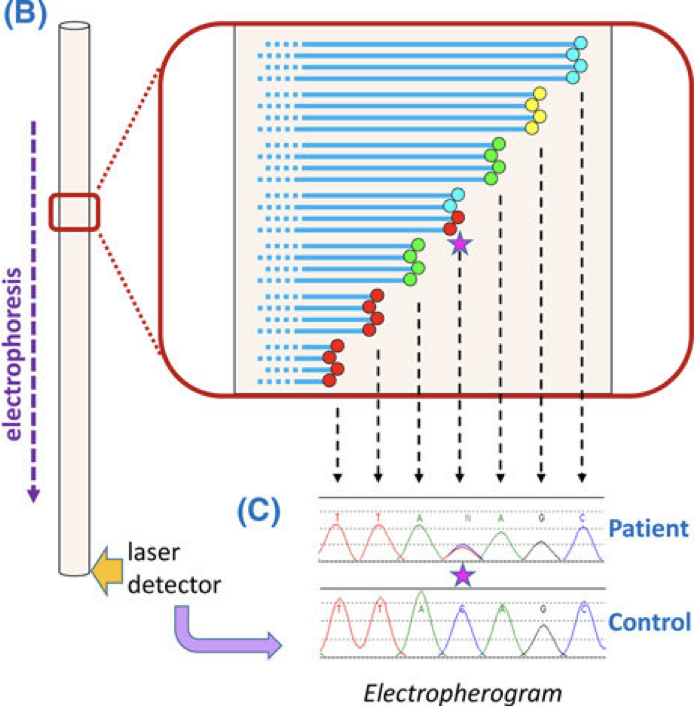
Résultat de séquençage avec diagnostique d’une mutation :