Cours : L’origine du génotype des individus
Mise à jour le 14/12/2025 par JBoscq
Introduction :
L’ensemble des gènes d’un individu, constitue ce que l’on appelle le génotype. Ce génotype varie, en fonction des allèles de chacun et est responsable du phénotype. Or le génotype des individus est un héritage de milliards d’années d’évolution. Il s’hérite des parents et dépend en partie du type de reproduction de ceux-ci : reproduction asexuée ou reproduction sexuée.
Sur notre planète, et d’après les quelque 2 millions d’espèces dénombrées et décrites à ce jour, seules 2 000 sont strictement asexuées. Toutes les autres possèdent une reproduction sexuée. Malgré tout, certaines espèces cumulent les deux modes de reproduction…
Photo de couverture : d’après wikipedia.com
Problèmes : Comment expliquer que 98% des espèces aient une reproduction sexuée ? Quelles conséquences les deux types de reproduction ont-elles sur les génotypes des descendants ? Quels mécanismes cellulaires favorisent la stabilité génétique et lesquels favorisent la variabilité ?
I- Reproduction asexuée et stabilité génétique

clones et stabilité génétique
A- Clones et stabilité génétique
La reproduction asexuée est assurée par la mitose. C’est une division permettant à une cellule mère de se diviser en deux cellules filles identiques à la cellule mère. La réplication semi-conservative précède la mitose. Cela permet de conserver le génome et le génotype d’une génération cellulaire à la suivante. Lors de la phase S de l’interphase précédant la mitose, le patrimoine génétique se duplique à l’identique (formation de chromosomes à 2 chromatides). Les cellules en division possèdent donc 2 copies du génome. Chaque copie est ensuite envoyée dans une des deux cellules fille lorsque, en anaphase, les chromatides sœurs de chaque chromosome se séparent et migrent chacune dans une des deux cellules filles. La mitose est donc un mécanisme qui favorise la stabilité des génotypes au cours des générations d’individus issus de reproduction asexuée.
Doc. 1 : La mitose
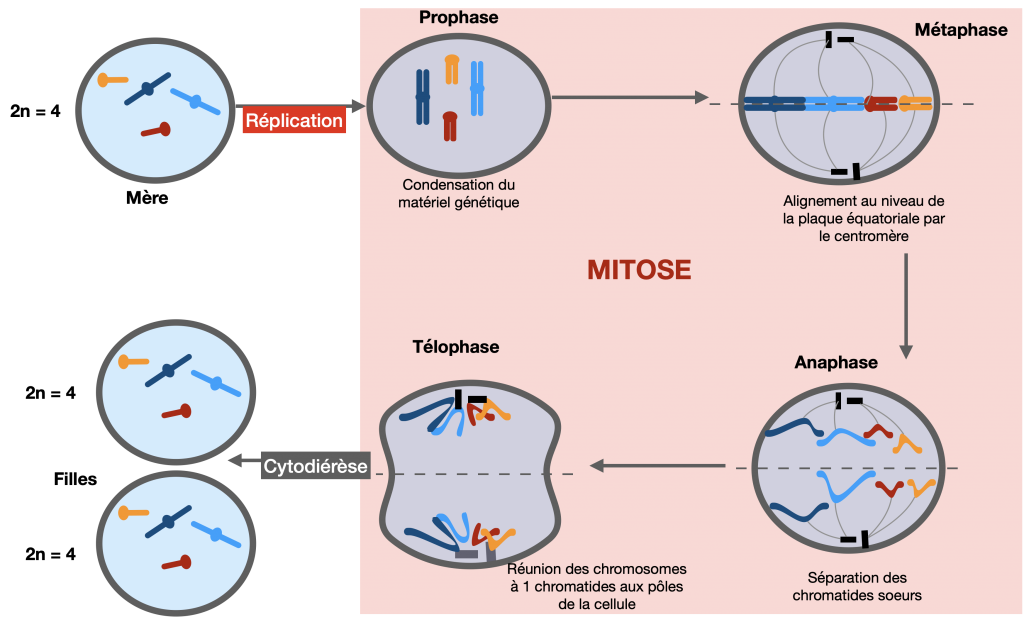
Une succession de mitoses produit des cellules toutes théoriquement génétiquement identiques. Elles forment ensemble un clone. Ces clones peuvent être constitués de cellules qui se séparent. C’est le cas des nombreuses bactéries mais aussi de nos cellules sanguines par exemples. Sinon, les cellules peuvent être associées dans un tissu grâce à une matrice extracellulaire qui les maintient ensemble. C’est le cas des différents organes d’un individu.

Définitions :
Mitose :
C’est la division cellulaire qui permet une répartition égale de l’information génétique d’une cellule-mère initiale à deux cellules-filles tout en conservant le caryotype au fil des générations cellulaires..
Clone :
Un clone est un groupe de cellules ou d’individus qui sont issus d’une même cellule ancestrale.
Sous clone :
ensemble de cellules qui diffèrent légèrement (à cause de mutations) des autres cellules du clone.
Matrice extracellulaire :
réseau moléculaire sécrété par les cellules et entourant ces dernières en les maintenant unies dont le to-ut forme un tissu.
La mitose permet la croissance d’un organisme de la cellule-œuf à l’adulte ainsi que le renouvellement tout au long de sa vie de ses cellules comme par exemple les cellules sanguines ou les cellules de la peau chez les animaux. Chez les végétaux, la mitose participe à la croissance des organes comme la racine ou la tige par augmentation du nombre de cellules : ce mécanisme s’appelle la mérèse. La division cellulaire est un phénomène sous contrôle. Un défaut de ce contrôle peut aboutir à la prolifération anarchique des cellules et à la formation de tumeurs.

Définition :
Tumeur :
Une tumeur est une grosseur plus ou moins volumineuse due à une multiplication excessive de cellules normales (tumeur bénigne) ou anormales (tumeur maligne). Les tumeurs bénignes (comme par exemple les grains de beauté, les verrues…) se développent de façon localisée sans altérer les tissus voisins. Les tumeurs malignes (cancer) ont tendance à envahir les tissus voisins et à migrer dans d’autres parties du corps, produisant des métastases
Toutes les cellules d’un organisme possèdent ainsi le même génome et le même génotype. Chaque organisme peut donc être considéré comme un clone cellulaire. Si plusieurs individus possèdent le même génome, issu de la reproduction asexuée ou de clonage artificiel, et qu’ils restent tous connectés, alors ils forment également un clone comme par exemple la forêt de Pando.
La forêt Pando : Bilan Nathan sur les clones 9’12 (voir TP-TD)
B- Variabilité génétique des clones
On peut noter une variabilité génétique entre les populations clonales qui sera d’autant plus marquée que la population clonale sera grande. En l’absence d’échanges génétiques avec l’extérieur, la diversité génétique dans un clone résulte de l’accumulation de mutations successives dans les différentes cellules. Ces mutations sont le plus souvent liées à des erreurs de réplication de l’ADN en phase S même si, à chaque division, elles sont plutôt rares : le taux moyen est de 1 mutation pour 106 paires de nucléotides copiés. Ce taux est variable selon les espèces, le type cellulaire et peut être amplifié par l’environnement (agents mutagènes conne les UV par ex.).

Lorsque qu’une mutation a lieu dans une cellule, elle se transmet à l’ensemble des cellules qui suivent et qui forment alors un sous-clone génétiquement légèrement différent des autres cellules du clone.
Chez l’humain, on estime à 1018 le nombre de mutations somatiques qu’un individu subira au cours de sa vie.
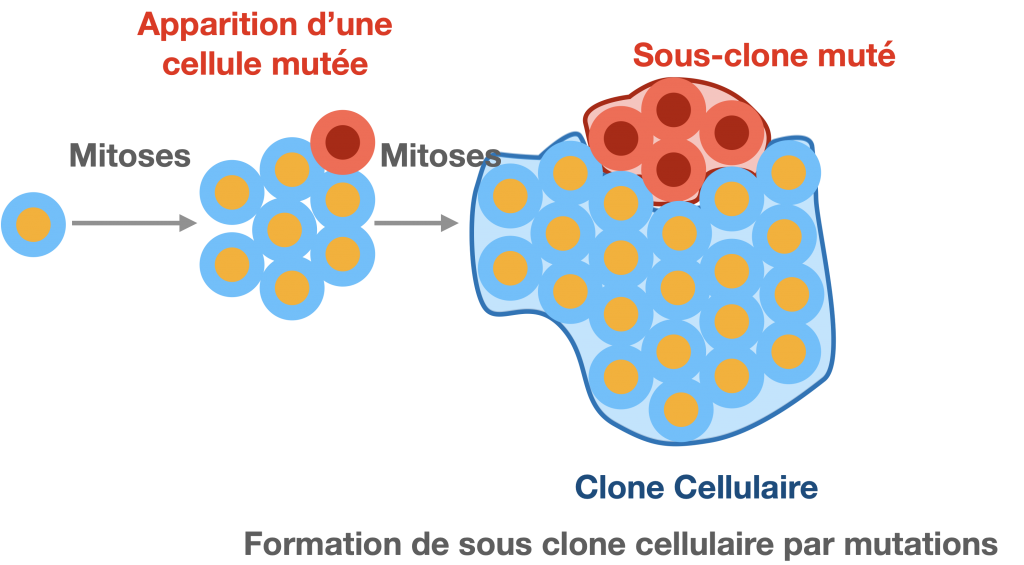
Remarque :
Dans leur environnement, les espèces à reproduction asexuée peuvent avoir des échanges génétiques avec l’extérieur et s’échanger des gènes (voir Chapitre 2, transferts horizontaux) ce qui va favoriser la diversification génétique du clone et faciliter l’évolution de ces espèces.
C– Conséquences des mutations
Les mutations peuvent avoir des conséquences variées en fonction de leur localisation dans le génome et le type cellulaire de l’individu.
Le génome humain possède 98% de séquences non codantes, c’est-à-dire non transcrites pour faire des ARN ou des protéines (ex introns, séquences répétées etc). La plupart des mutations ayant lieu dans ces séquences n’ont donc pas d’influence sur le phénotype. Mais parmi ces séquences non codantes, certaines sont liées à séquence codante et forment un système génique : on les appelle séquences régulatrices. Elles sont le lieu de fixation de facteurs de transcription qui vont permettre d’initier et de réguler la transcription du gène (intensité, lieu, chronologie et durée d’experssion). Des mutations dans ces séquences entrainent donc des modifications phénotypiques parfois considérables (ex : mouches antennapedia) sans modification de la protéine concernée.
Doc. 2 : Souche sauvage et souche antennapedia chez drosophila melanogaster
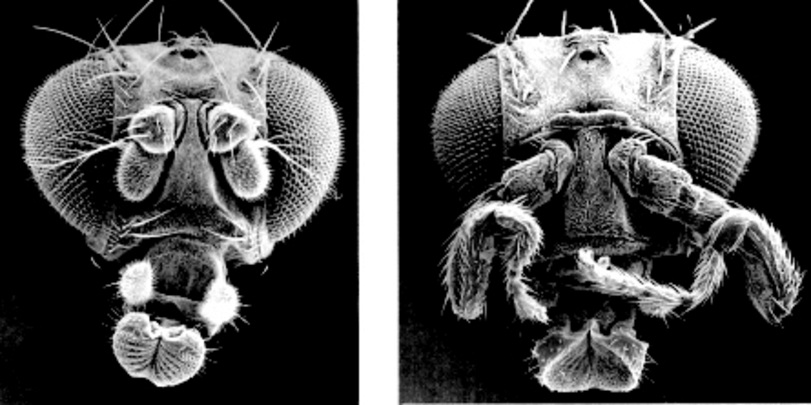
Les mutations ayant lieu dans les séquences codantes modifient le plus souvent la structure de la protéine et entrainent donc des modifications phénotypiques.
Les modifications qui ont lieu ont un effet le plus souvent légèrement délétère, beaucoup moins souvent franchement délétère, rarement létal et quasi jamais avantageux. Cette observation, se comprend facilement si l’on considère que les systèmes génétiques sont les résultats de processus d’optimisation par sélection naturelle qui se sont déroulés pendant des millions, voire parfois des milliards d’années, et qu’il est donc beaucoup plus facile de les détériorer que de les améliorer.
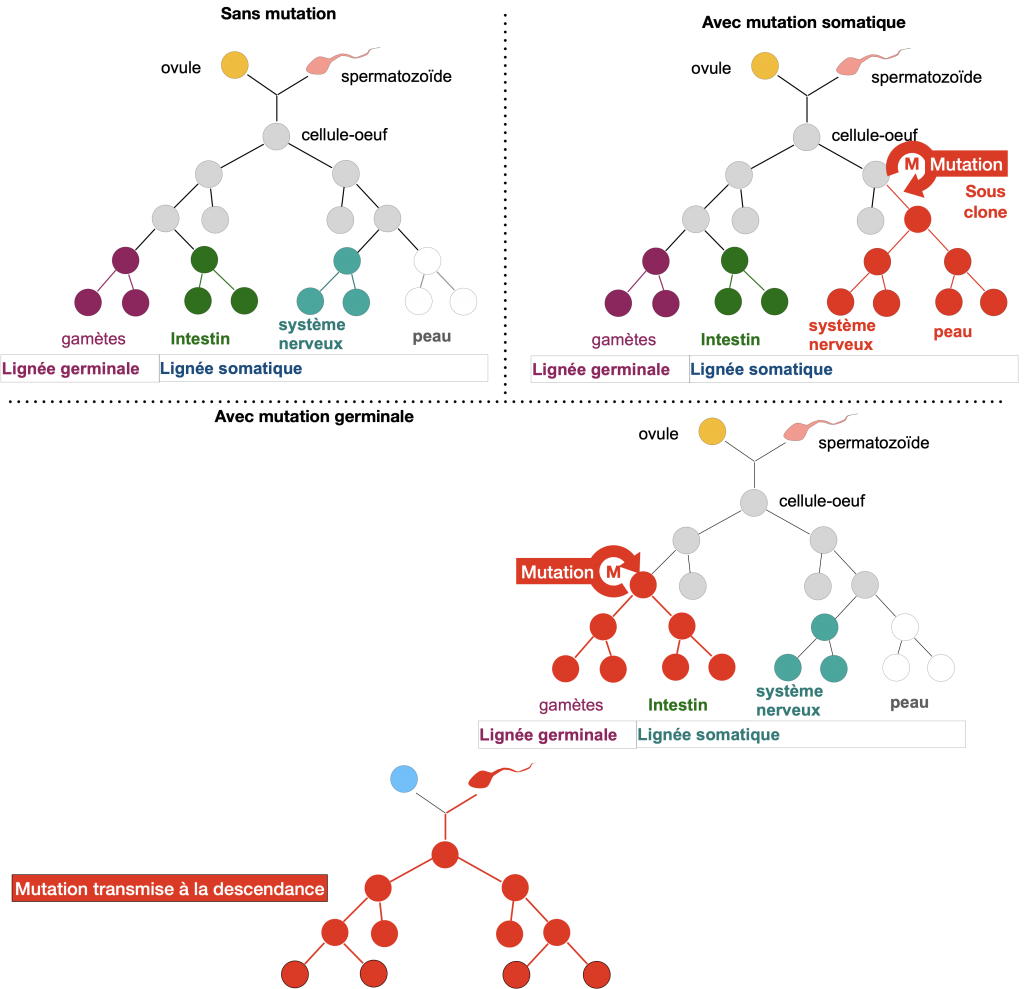
Les mutations ayant lieu dans les cellules somatiques sont généralement à l’origine de dysfonctionnements cellulaires. Les cellules peuvent par exemple acquérir une capacité de division infinie et de migration dans l’organisme et former des métastases (= tumeurs cancérigènes). Mais dans tous les cas, ces mutations disparaitront à la mort de l’individu.
Les mutations ayant lieu dans les cellules germinales, par contre, peuvent être transmises via les gamètes aux descendants et sont majoritairement à l’origine de maladies génétiques et rarement à l’origine d’innovations entrainant une diversité des allèles des populations.
Doc. 3 : Lignées clonales et mutations
II- Reproduction sexuée et diversité génétique
La reproduction sexuée procure un avantage non négligeable en terme d’évolution en produisant des individus génétiquement différents des « parents » créés par la réalisation de nouvelles combinaisons d’allèles au cours du cycle de reproduction : c’est le brassage génétique.
Ces individus génétiquement différents sont potentiellement adaptables à différents milieux et aux variations du milieu, ce qui explique de 98% des espèces aient une reproduction sexuée.
A- Vocabulaire de génétique

Définitions :
Caryotype
présentation ordonnée du nombre et de la forme des chromosomes.
Ploïdie
caractérise le nombre lots de chromosomes contenus dans une cellule :
une cellule possédant un seul lot de chromosomes est haploïde (la formule chromosomique est : n = nombre total de chromosomes)
une cellule possédant deux lots de chromosomes est diploïde (la formule chromosomique est 2n = nombre total de chromosomes), un des lots s’hérite du père, l’autre de la mère. Dans un caryotype, on les range par paires. Les 2 chromosomes de ces paires sont dits homologues car ils possèdent les même gènes (mais pas forcément les mêmes allèles !)
Il existe (notamment dans le monde végétal) des individus polyploïdes : tétraploïdie = 4n (pomme de terre), hexaploïdie = 6n ( blé tendre) etc.
Attention : La formule chromosomique noté 2n = nombre total de chromosomes correspond à des paires de chromosomes, qu’ils soient simples ou doubles. La formule chromosomique noté n = nombre total de chromosomes peut être appliquée à une cellule possédant des chromosomes doubles.
Phénotype
ensemble des caractères d’un individu. (Par convention, on écrit le phénotype entre crochets, en utilisant les symboles pour les caractères considérés).
Génotype
ensemble des allèles d’un individu. (Par convention, on écrit le génotype entre parenthèses, en utilisant les symboles pour chaque allèle considéré).
Génome
ensemble des gènes d’un individu et d’une espèce.
Gène
portion d’ADN précise, portant l’information nécessaire l’apparition d’un caractère chez l’individu
Allèle
version d’un gène se distinguant d’une autre par une ou plusieurs différences dans la séquence nucléotidique et induisant une variation du caractère.
Hétérozygote
qualifie un individu portant 2 allèles différents pour un gène donné.
Homozygote
qualifie un individu portant 2 allèles identiques pour un gène donné.
Dominant
qualifie un allèle s’exprimant toujours et dont l’expression confère à la cellule / à l’organisme son phénotype. (Il est représenté le plus souvent par une lettre MAJUSCULE ou une lettre minuscule suivi d’un +).
Récessif
qualifie un allèle dont l’expression est masquée/non visible dans le phénotype d’un individu hétérozygote et ne s’exprimant que chez un individu homozygote. (Il est représenté le plus souvent par une lettre minuscule).
lignée pure
individus dont le génotype est connu et stable homozygote pour le gène étudié.
Monohybridisme
Croisement entre deux parents qui diffèrent par un seul caractère = 1 seul gène incriminé
Dihybridisme
Croisement de deux organismes parents différant par deux caractères héréditaires = gouvernés par 2 gènes.
B- Méiose et fécondation : la base du brassage génétique

A-0 Bases génétiques
Chez les individus pratiquant la reproduction sexuée, le cycle de développement est ponctué par deux processus complémentaires : la méiose et la fécondation, délimitant une phase haploïde (n) (les gamètes) et une phase diploïde (2n) (toutes les autres cellules, somatiques ou germinales)
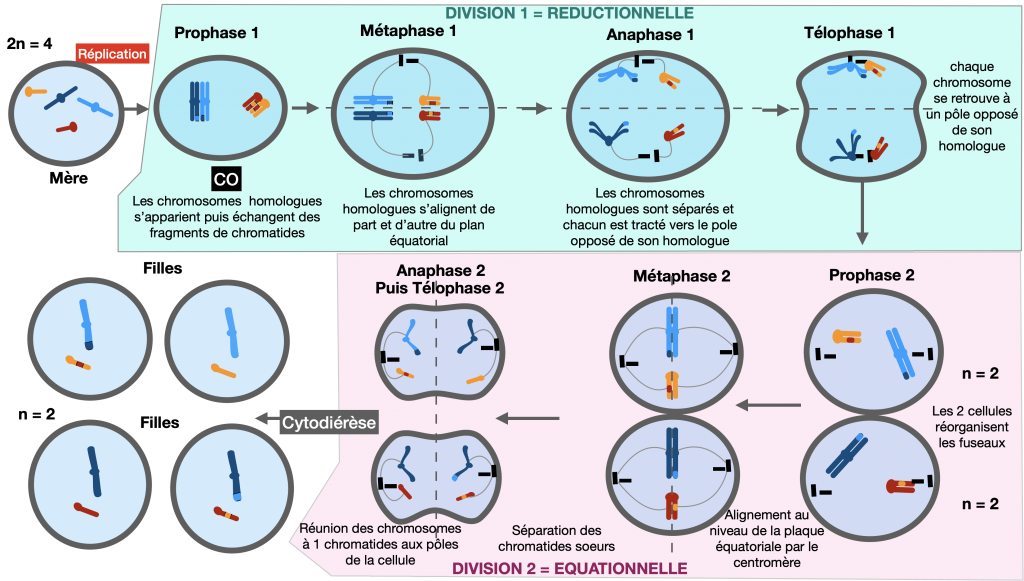
La méiose est le processus permettant la formation des gamètes dans les gonades : c’est une succession de deux divisions : réductionnelle (il y a séparation des chromosomes homologues) puis équationnelle (il y a séparation des chromatides sœurs). A partir d’une cellule germinale diploïde (2n), il y formation de 4 gamètes / cellules haploïdes (n). (La 1ère division est toujours précédée d’une réplication de l’ADN permettant d’obtenir des chromosomes doubles.)
La fécondation correspond à la fusion de deux gamètes haploïdes (n) soit d’un ovule avec un seul spermatozoïde. Cette fusion aboutit à la formation d’une cellule-œuf ou zygote de nouveau diploïde (2n).
Méiose et fécondation sont donc des processus compensateurs : leur alternance assure le maintien du caryotype d’une génération à l’autre permettant la conservation du nombre de chromosomes caractéristique de l’espèce.
Doc. 4 : Méiose
C- Les lois del’hérédité

A1- Mendel et Morgan : Reproduction sexuée et diversité génétique
Avertissement :
- apprendre vocabulaire + Conventions d’écritures génétique + méthodologie d’analyse génétique
- Bien savoir réutiliser les schémas de la méiose pour expliquer et placer les allèles correctement avec leurs abréviations et l’écriture ad hoc + Schémas explicatifs comme les CO

Gregor Mendel a réalisé de nombreux croisements (surtout célèbres chez le pois) entres parents de phénotypes distincts. Son but est de comprendre les mécanismes de transmission et de brassage (« mélange ») des caractères sur plusieurs générations lors de la reproduction sexuée. En 1866, il en déduit les 3 lois de de l’hérédité mettant en évidence les notions fondamentales de la génétique. Ces 3 lois concernent les notions d’homozygotie/hétérozygotie et de dominance/récessivité des allèles ainsi que la notion de brassage génétique lors de la formation des gamètes. En cas de dihybridisme (lorsqu’il étudie deux caractères/ 2 gènes lors de ses croisements) il observe que les mêmes lois s’appliquent. Cependant, cela ne fait appel qu’à des gènes portés par des chromosomes différents.
Complément : Les lois de Mendel
De ses observations Mendel déduit deux principes fondamentaux, auxquels on ajoutera plus tard un troisième qui en découle. C’est précisément des expériences menées sur les pois qui permirent à Mendel de formuler les principes intervenant dans l’hérédité, c’est pourquoi, même s’il a fait d’autres études génétiques, on résume souvent son travail à l’étude des pois.
Que découvrit Mendel ?
- Un caractère peut présenter deux formes différentes (aujourd’hui appelées allèles ou gènes homologues).
- Un organisme hérite de deux facteurs pour chaque caractère (ce que Mendel a appelé « facteurs héréditaires » est aujourd’hui appelé « allèles»).
- Le phénotype dominant masque celui qui est récessif. Mendel a noté le phénotype dominant à l’aide d’une majuscule et l’autre, le récessif, à l’aide de la même lettre mais en minuscule. Il a par la suite fait le lien avec les facteurs héréditaires.
- Les deux facteurs se séparent durant la formation des gamètes (Loi de ségrégation qui correspond à la séparation des paires de chromosomes homologues durant la méiose)
- Les paires de facteurs se séparent de façon indépendante les unes des autres (Loi de ségrégation indépendante qui correspond à l’assortiment indépendant des paires de chromosomes homologues à la métaphase 1 de la première division méiotique)
Les 3 lois qui découlent de ces observations et encore en application aujourd’hui sont :
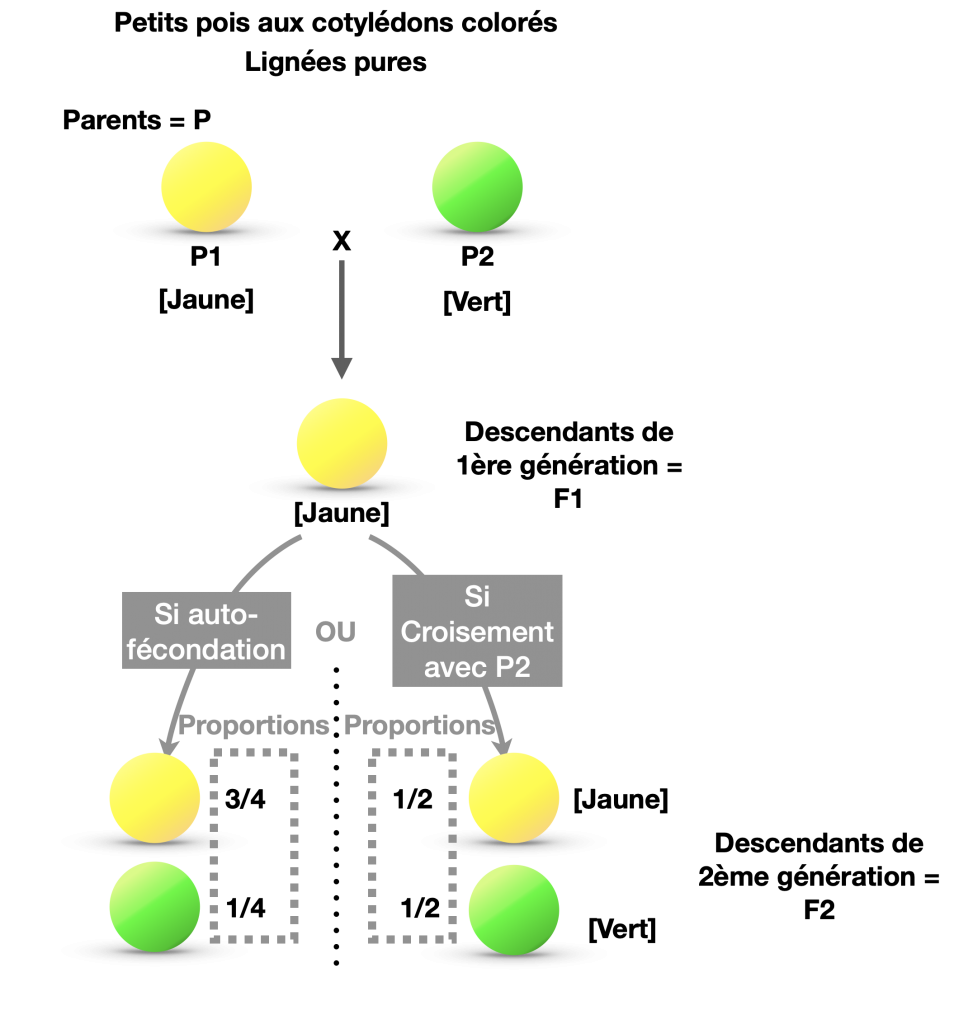
- Première loi : Loi d’uniformité des hybrides de première génération : Si 2 homozygotes sont croisés par rapport à un seul caractère, tous les descendants F1 sont identiques et leur phénotype qui s’exprime reflète la relation de dominance (ou codominance) d’un phénotype par rapport à l’autre .
- Deuxième loi : Loi de disjonction des allèles : En croisant F1 x F1, on observe un déséquilibre dans le nombre de descendants de phénotype dominant et récessif avec une distribution de type 3/4 et 1/4.
- Troisième loi : indépendance de la transmission des caractères : Cette règle ne s’applique que si les gènes responsables des caractéristiques se situent sur différents chromosomes ou s’ils sont éloignés sur le même chromosome.
Ce qui a manqué à Mendel dans son étude : Le support de l’information : l’ADN et les chromosomes, et notamment la possibilité d’échanges intrachromosomiques entre chromosomes homologues.
Doc.5 : Monohybridisme chez le pois

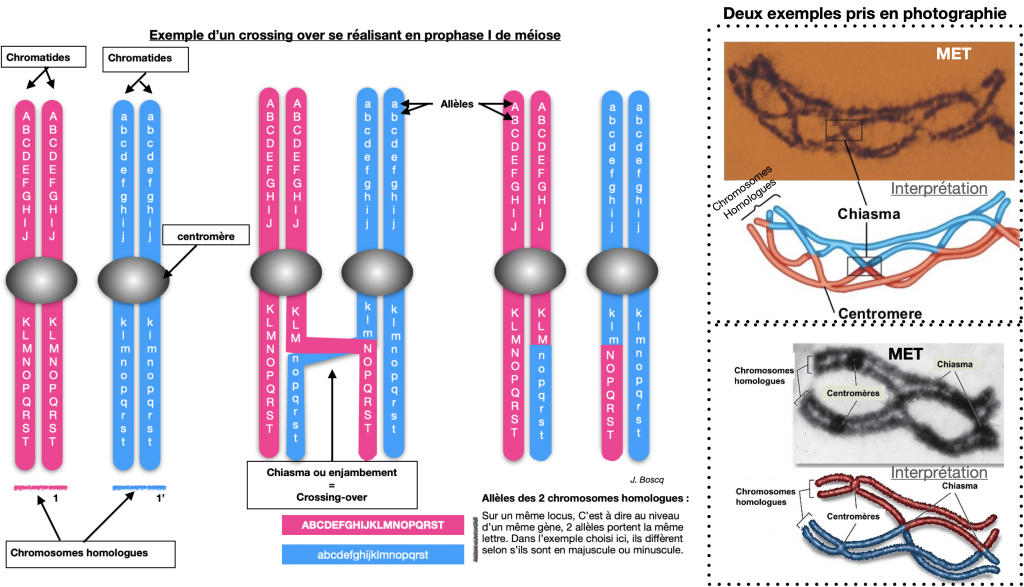
Thomas Morgan en 1910, entreprend de vérifier ces lois en travaillant sur les croisements de drosophiles. Il mit en évidence que tous les gènes ne sont pas forcément indépendants (« séparables » facilement dans les gamètes). En effet de nouveaux phénotypes, différents des phénotypes parentaux, apparaissent selon des proportions déterminées : On parle de phénotypes «recombinés». Des échanges entre chromosomes homologues peuvent s’opérer, on appelle cela des Crossing-overs ou enjambements ou chiasmas.
Il démontra aussi qu’il existe une hérédité liée au sexe. En effet, chez de nombreuses espèces, les femelles possèdent deux chromosomes sexuels homologues avec les mêmes gènes et donc 2 allèles pour chaque gène. Les allèles dominants masquent les allèles récessifs . Mais les mâles, qui ont deux chromosomes sexuels différents, possèdent certains allèles en un seul exemplaire qui s’exprimeront alors systématiquement. Cela modifie donc les proportion-types d’apparition de certains caractères.
Doc.6 : Explication du brassage par crossing-overs ou chiasmas ou enjambements.
D- La mise en application des lois, étude de quelques cas

Etudes génétiques : Les croisements de Morgan
1) Le brassage interchromosomique
=> si les gènes sont situés sur des chromosomes différents, « gènes indépendants»
Le brassage entre allèles portés par des paires de chromosomes différents est appelé brassage interchromosomique. Il a systématiquement lieu lors de la méiose. Cependant, il ne peut être mis en évidence que si 2 caractères sont étudiés et si l’individu est hétérozygote pour les gènes considérés.
Ce brassage est le résultat du positionnement aléatoire des chromosomes homologues lors de la méiose, en métaphase I. Cela conditionne leur sens de migration en anaphase I.
Doc.7 : Méiose permettant la fabrication de gamètes en considérant 2 gènes indépendants
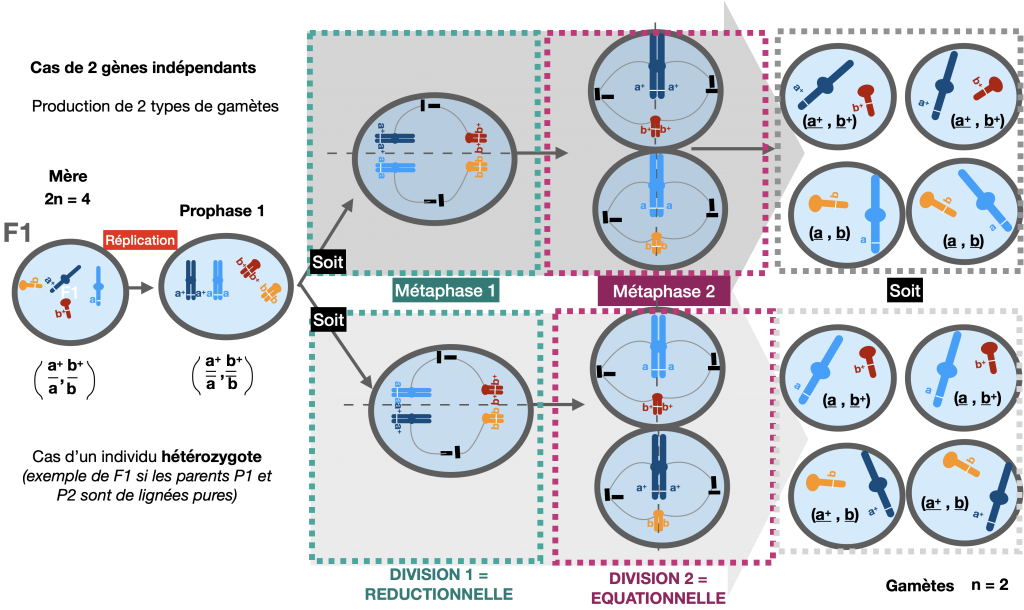
Ce processus aboutit à la création de 4 types de gamètes différents. Chacun posséde une association d’allèles différente de celle des parents de lignée pure. Ces nouvelles associations peuvent être mises en évidence lors d’un test-cross car elles engendrent des individus au phénotype recombiné.
Définitions :
Phénotype recombiné
Caractère possédant des caractéristiques mixtes issues des 2 parents.
Phénotype parental
Caractère ressemblant intégralement à l’un des 2 parents.
Un croisement-test ou test-cross est un croisement entre un individu à étudier (donc au génotype inconnu et phénotype dominant) et un individu au phénotype récessif (donc homozygote) pour les gènes étudiés. Si l’individu au phénotype récessif est l’un des parents initiaux, alors on parle de back-cross.
Lors d’un test-cross avec un individu hétérozygote pour des gènes indépendants, l’apparition des phénotypes recombinés et des phénotypes parentaux est équiprobable. Les 2 types de gamètes -recombinés et parentaux- sont produits en proportions identiques.
IMPORTANT : Bien savoir refaire les schémas d’interprétation vus en TP ou dans les activités.
2) Le brassage intrachromosomique
=> si les gènes sont sur un même chromosome : on parle de «gènes liés»
savoir faire le schéma d’un crossing over
Bien que deux gènes soient portés par le même chromosome, un brassage de leurs allèles (portés par leschromosomes homologues) existe. On l’appelle brassage intra chromosomique.
Lors de l’appariement des chromosomes homologues en prophase 1, des échanges de portion des chromatidespeuvent se produire au niveau de chiasmas. Il s’agit de crossing-over (ou enjambement).
La fréquence des crossing-over (= fréquence des phénotypes recombinés) est proportionnelle à la distance entre les gènes étudiés (Voir exercice1 d’approfondissement).
Doc.8 : Méiose permettant la fabrication de gamètes en considérant 2 gènes liés
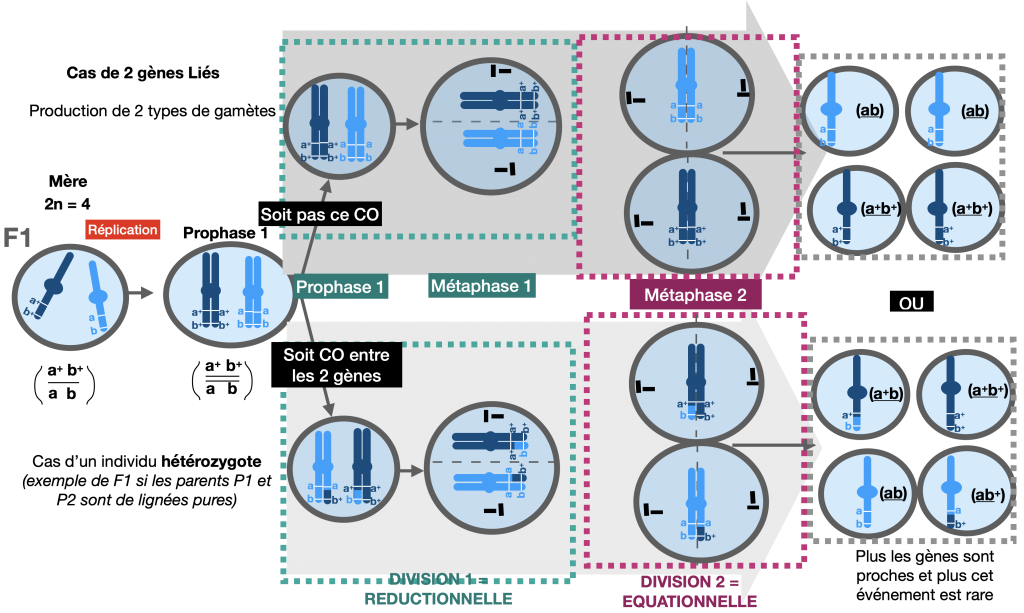
Si l’individu est hétérozygote pour les 2 gènes que l’on étudit alors ce processus aboutit à un échange d’allèles entre les chromosomes homologues. Cela donne naissance à des chromatides remaniées, qui possèdent une nouvelle combinaison d’allèles, différente de celle des parents.
Si des crossing-overs ont lieu à chaque méiose, la fréquence des méioses avec crossing-over dépend des gènes étudiés. Plus des gènes sont proches et plus le CO est un événement rare. Cela explique que les gamètes avec chromosomes remaniés apparaissent en plus faible proportion que les gamètes de type parental. Les 4 types de phénotypes issus d’un test-cross ne sont donc pas équiprobables et apparaissent en proportions différentes. Les phénotypes recombinés ont moins de chance d’apparaitre que les phénotypesparentaux.

Un petit calcul :
Estimation du nombre de recombinaisons chez l’Homme pour un gamète : Calculez le nombre de recombinaisons possibles dans l’espèce humaine
Doc.9 : nombre de combinaisons différentes à l’issue de la méiose et de la fécondation.
| Critère pris en compte | Valeur | Nombre de combinaisons possibles |
| Nombre total de chromosomes | 23 | |
| Nombre moyen de gènes par chromosome | 1300 | |
| Proportion d’hétérozygotie | 6,7 % | |
| Proportion de Crossing Over sur l’ensemble des gènes | 3 % | |
| Total de Combinaisons possibles en méiose | | |
| Total d’individus différents possibles après fécondation | |
Remarque :
Dans l’espèce humaine possédant, 23 paires de chromosomes, si l’on ne considère que le brassage inter chromosomique, un individu peut produire 223 gamètes génétiquement différents (soit plus de 8 millions).
Mais au cours d’une méiose, les deux types de brassages ont lieu simultanément. Avec en moyenne 1300 gènes par chromosome, un taux d’hétérozygotie de 6.7%, et un taux de crossing-over moyen de 3%, le nombre de nouvelles combinaisons d’allèles est alors beaucoup plus importante : 260. La diversité des gamètes est donc considérable !
Il faut rajouter à cela, la fécondation, qui est la rencontre aléatoire d’un spermatozoïde et d’un ovule, puis leur fusion. Cela va encore amplifier le brassagegénétique: La diversité potentielle des zygotes est donc quasi infinie de l’ordre de 260 x 260 = 1.32 1036. Vous avez plus de chance de gagner au loto (1 chance sur 20.106), que de trouver 2 êtres identiques issus d’une reproduction sexuée différente, mais ce n’est évidemment pas une incitation à jouer !
La reproduction sexuée est donc responsable d’une très importante diversité génétique intraspécifique et de l’unicité de chaque individu (possédant une combinaison unique et nouvelle d’allèles).
Attention, dans une dissertation pour démontrer le brassage, de ne pas oublier la fécondation.
3) Bien distinguer ce que le problème de génétique vous demande
Test cross ou F1 x F1 ?
Le test Cross ou croisement test :
C’est le croisement d’un individu dont on ignore le génotype avec un individu entièrement récessif. Ainsi, la descendance donne un résultat dont la diversité des phénotypes représente la diversité allélique de l’individu inconnu.
Ce qui est intéressant dans un test cross à 2 gènes est le fait que nous pouvons déterminer s’ils sont liés ou non. Si phénotypes parentaux = phénotypes recombinés alors les gènes sont indépendants. Si phénotypes parentaux > phénotypes recombinés, alors les gènes sont liés.
Le croisement F1 x F1 :
C’est un croisement permettant de voir si les lois de Mendel sont appliquées. Si les parents sont de souches pures alors F1 est hétérozygote. Une F1 x F1 permettra de voir une répartition de 3/4 et 1/4 pour 1 gène et 9/16, 3/16, 3/16 et 1/16 pour 2 gènes. Attention si les parents ne sont pas de souches pures, il faut alors faire toutes les hypothèses possibles. Dans ce type d’exercice on conclura alors que les résultats obtenus suivent bien une loi mendélienne (à condition que les calculs coïncident avec les résultats théoriques).
Voir tableau récapitulatif
Doc. 10 : Que cherche-t-on avec un test cross ou un croisement F1xF1 ?


III- L’identification des génotypes dans l’espèce humaine
Chaque être humain possède donc une combinaison unique d’allèles.
Comment identifier les allèles portés par chaque individus ?
A- Des études d’arbres généalogiques

A2- génétique humaine
Les analyses génétiques chez les animaux ou végétaux se fondent sur l’étude de la transmission héréditaire des caractères observables dans des croisements issus le plus souvent de lignées pures homozygotes et ne différant que par un nombre limité de caractères. Ce type d’études est irréalisable dans l’espèce humaine où le nombre de descendants est faible, le temps entre deux générations est élevé et il est surtout éthiquement impossible de diriger des « croisements ».
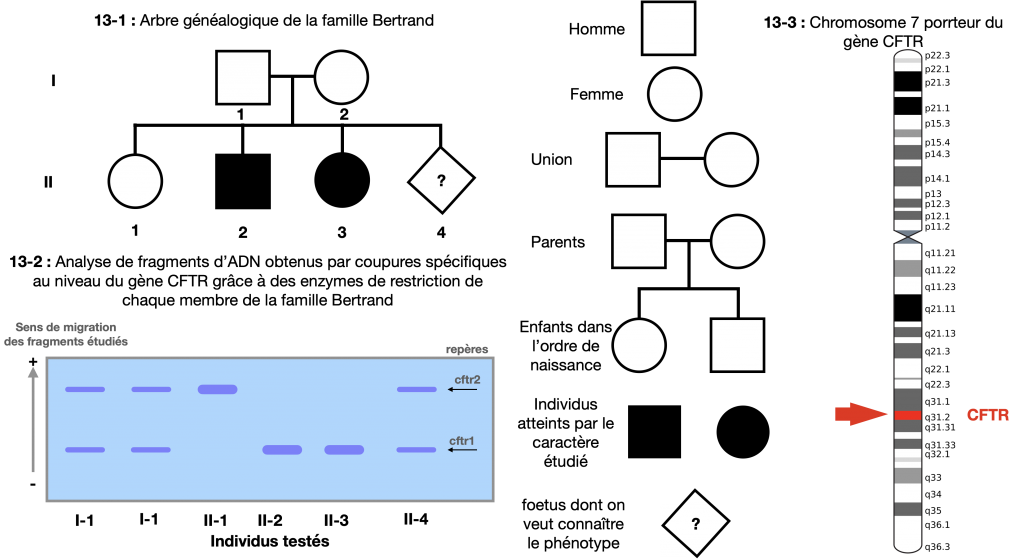
Le premier membre d’une famille qui retient l’attention du généticien est appelé propositus. En général, il a un phénotype exceptionnel, comme par exemple être atteint d’un type de maladie. C’est pourquoi, très souvent, l’analyse d’arbres généalogiques est centrée sur l’étude de maladies, même si cela peut aussi porter sur d’autres caractères exceptionnels comme la pilosité de l’oreille par exemple. Le généticien retrace alors le cheminement du phénotype tout au long de l’histoire de la famille et aboutit à un arbre généalogique tout en utilisant des symboles conventionnels.
Les analyses génétiques modernes ont pour but de détecter la présence d’allèles, le plus souvent responsables de maladies génétiques ou d’en évaluer le risque de les porter. Ces enquêtes sont complétées par de nouvelles techniques d’exploration du génome permettant de mettre en évidence la présence de ces anomalies.
Doc. 11 : Exemple d’un petit arbre généalogique portant sur un caractère
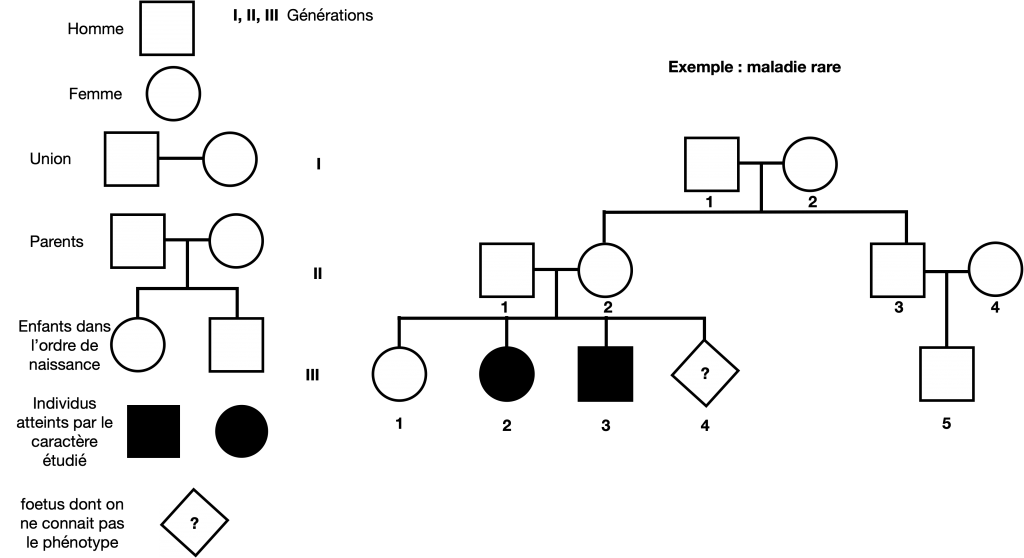
Dans ce cas, on peut noter l’allèle a responsable du phénotype [malade] (ou exceptionnel) et a+ responsable du phénotype sain [+]
Les parents sont alors forcément hétérozygotes (a+//a) puisque 2 de leurs enfants sont touchés par une maladie ou un caractère exceptionnel et eux mêmes sont sains
III-1 peut être homozygotes ou hétérozygotes, un test est nécessaire pour déterminer III-4 car à risque
B- Des outils modernes pour diagnostiquer
Après enquête génétique, au sein d’une famille, des analyses ADN permettent de poser un diagnostic plus fiable et d’évaluer un risque de transmission chez les parents ou même de faire un prélèvement chez le foetus (amniosynthèse ou prélèvement ombilical) pour diagnostiquer directement la positivité à une maladie génétique.
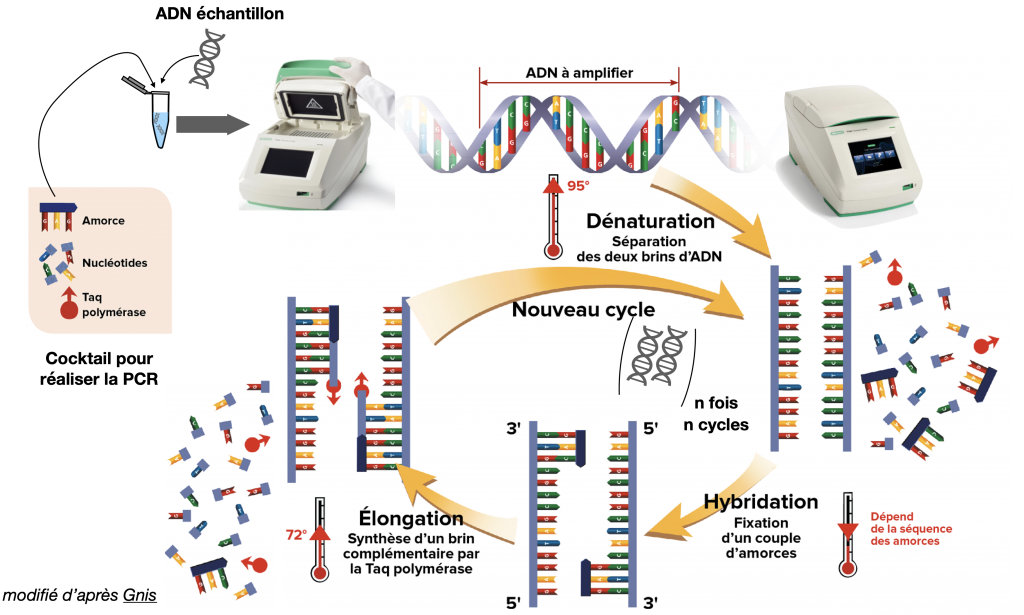
1- La technique de PCR

Amertume et PCR (après les écrits)
Quand on prélève des cellules d’un individu, on va commencer par amplifier son ADN. Autrement dit, les prélèvements n’ont pas assez de quantité d’ADN pour s’analyser. La technique couramment employée pour amplifier cette ADN s’appelle la PCR ou Polymerase Chain Reaction qui consiste à répliquer en boucle l’ADN grâce à une ADN polymérase (la Taq Polymérase) particulière empruntée des bactéries des sources hydrothermales. Cette méthode peut s’appliquer à une séquence particulière, puisqu’on peut polymériser alors uniquement une séquence recherchée, à condition d’avoir la séquence initiatrice, appelée « primer ».
Doc. 12 : La technique de PCR
2- L’analyse de la banque de données
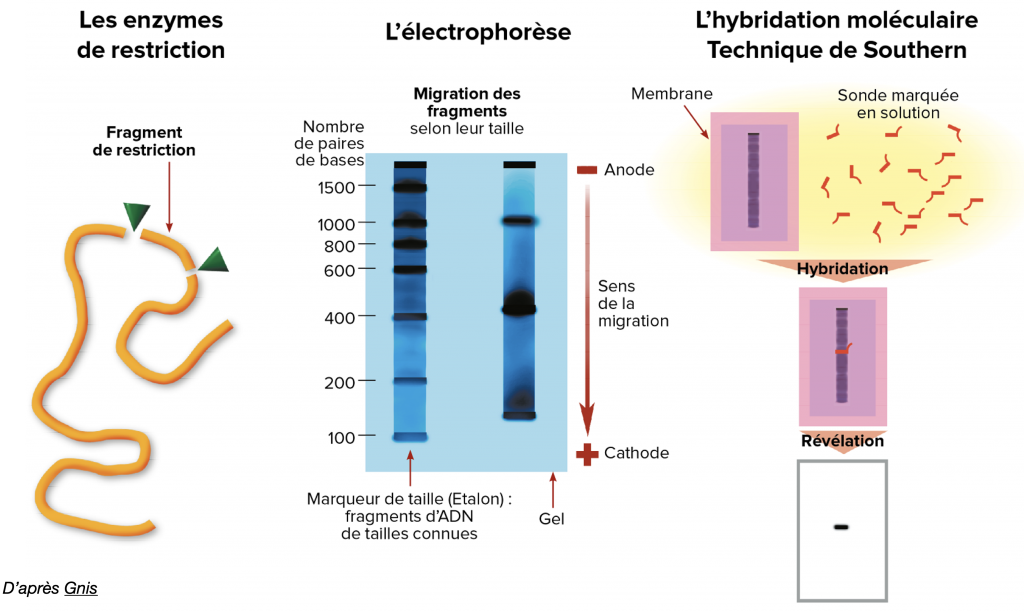
Une fois cette amplification réalisée, on peut traiter l’ADN avec des outils moléculaires (exemple : enzymes de restriction) qui vont reconnaître des séquences particulières pour couper l’ADN spécifiquement. Le choix de ces enzymes est large et dépend de ce que l’on veut mettre en évidence.
On peut ensuite réaliser une électrophorèse ou une hybridation par sonde immunofluorescente permettant de révéler le fragment d’ADN recherché. La présence ou non des séquences recherchées nous révèlera le génotype de l’individu
Doc. 13 : Quelques techniques de révélation de l’ADN.
Complément : La puce à ADN
L’ensemble des ARN présents dans une cellule à un moment donné et en fonction des conditions donne une image de l’état fonctionnel du génome… Les puces à ADN permettent d’étudier cet état par l’observation simultanée de l’expression de plusieurs milliers de gènes dans une cellule ou un tissu donné, mesurant ainsi les modifications des différents états cellulaires. La technique des puces à ADN est basée sur le principe d’hybridation de deux fragments d’acides nucléiques complémentaires pouvant s’associer et se dissocier de façon réversible grâce à la chaleur et la concentration saline du milieu ainsi qu’un marquage fluorescent. L’intensité de fluorescence révèlera le degré de fonctionnalité des gènes étudiés.

Complément : L’élaboration de banque de données génétiques : un problème également d’éthique
Les nouvelles technologies permettant l’identification de génotypes particuliers ont permis d’améliorer différentes recherches en ADN, telles que la recherche criminelle, la recherche de parentalité, ou même de filiation et de typages des origines de l’espèce humaine. En police criminelle, si la technique s’emploie depuis un certain temps, elle est devenue très précise et permet de confondre des criminels avec certitude.
Néanmoins, si une banque de données semblait nécessaire en criminalistique, le développement de tests familiaux privés et l’ouverture des banques d’ADN aux assurances et firmes pharmaceutiques laisse paraître une énorme faille en bioéthique. En effet, que penser de la vente du génome des islandais à de puissants groupes pharmaceutiques ? Ou encore du fait que des tests d’ADN familiaux, collectés à grande échelle dans des bases de données publiques, permettraient, selon un article publié dans Science, d’identifier 60 % de la population américaine ? Est ce qu’une personne qui aurait une prédisposition à une maladie cardiaque n’aurait plus le droit à une couverture médicale ou alors devrait-il payer plus que n’importe qui d’autre ? A vous de vous faire votre propre avis…
Avertissement : Faîtes attention à l’objectivité de sites en bioéthique très bien faits, mais en réalité réalisés par des groupes engagés (contre la PMA, contre les OGM, contre l’évolution…). Ne prenez que les faits, et émettez votre propre avis, ne vous laissez pas dicter votre façon de penser.
C- Un exemple d’étude de maladie : la mucoviscidose
La mucoviscidose est la maladie génétique la plus fréquente en France (1 nouveau-né sur 4 000 environ). Les individus homozygotes, possédant deux allèles déficients, développent systématiquement la maladie. Deux parents hétérozygotes, porteurs sains, auront 1 risque sur 4 d’avoir un enfant déclarant la maladie. L’étude des arbres généalogiques est donc important pour prévoir le risque de transmission et les tests de dépistage précoces, afin de prendre en charge le plus rapidement possible la maladie.
Le gène incriminé dans la maladie est CFTR (Cystic fibrosis transmembrane conductance regulator) présent au niveau du chromosome 7. La protéine CFTR est une protéine présente dans la membrane des cellules de différents muqueuses : respiratoire, digestive… Elle fonctionne comme un canal qui permet l’échange d’ions chlorures entre l’intérieur et l’extérieur de la cellule. Lorsque son gène est muté, le canal dysfonctionne. Par le biais de différentes cascades biologiques, il en résulte notamment une diminution de l’eau excrétée au niveau des muqueuses et, en conséquence, une inflammation et un épaississement du mucus qui le recouvre. Ce phénomène entraîne l’apparition des symptômes habituels de la mucoviscidose.
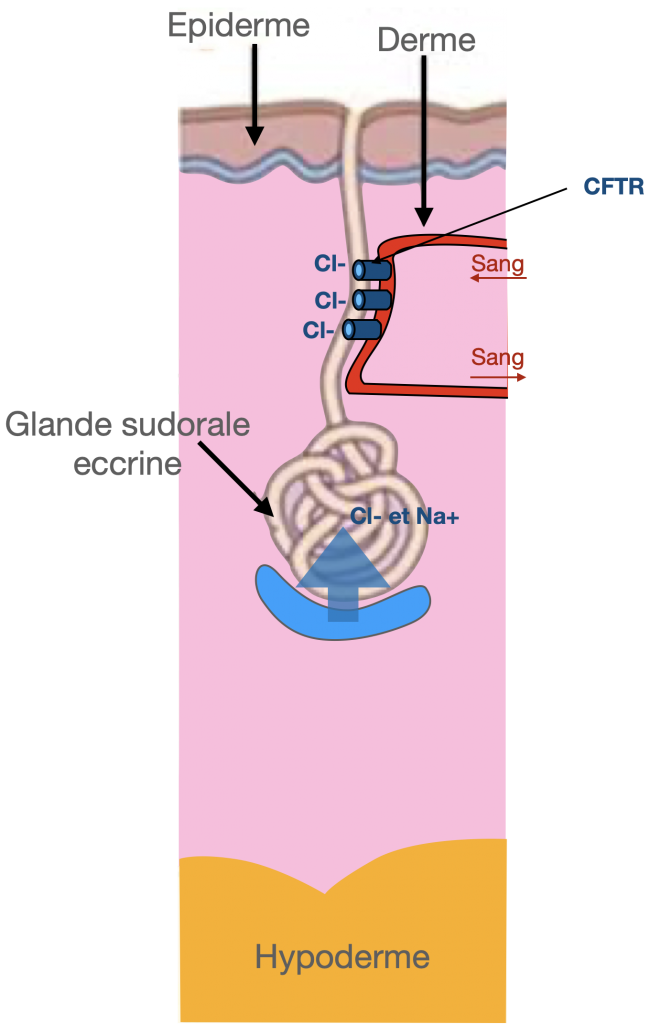
La mucoviscidose est une maladie dont l’expression est plus ou moins sévère selon la nature des mutations portées par le patient. La mutation Delta F508, expose par exemple le patient à une forme relativement sévère de mucoviscidose.
Dans l’immense majorité des cas, la maladie est diagnostiquée dès la naissance de l’enfant, grâce à la démarche de dépistage systématique implantée dans toutes les maternités de France depuis 2002
Il existe des traitements symptomatiques mais aussi des thérapies plus complexes visant à corriger les gènes défectueux dans les cellules des malades : on parle de thérapie génique. Pour l’instant, dans le cadre de la mucoviscidose, les traitements ne permettent pas de guérir de la maladie.
Doc. 14 : Evaluation du risque de mucoviscidose chez un foetus d’une famille à risque
IV- Anomalies de méiose et conséquences
1- Anomalies de méioses et troubles génétiques
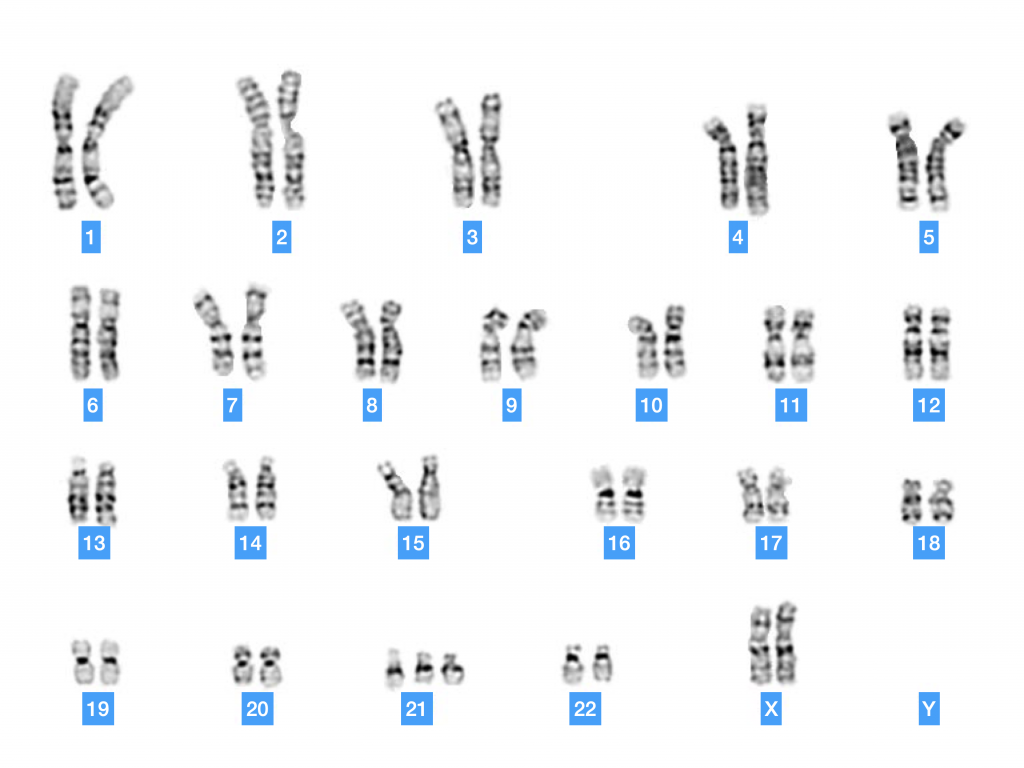
Si il existe des anomalies de répartition des chromosomes homologues lors de la division 1 ou 2 de méiose, les gamètes produits peuvent avoir un caryotype anormal avec un chromosome surnuméraire. On parle alors de trisomie. Exemple Trisomie 21. Il peut également y avoir un déficit de chromosome (monosomie). Cependant beaucoup de ces anomalies ne sont pas viables et aboutissent à une fausse couche ou une non-nidation de l’embryon.
Doc. 15 : Caryotype d’un individu ayant un syndrome de Down (trisomie 21).
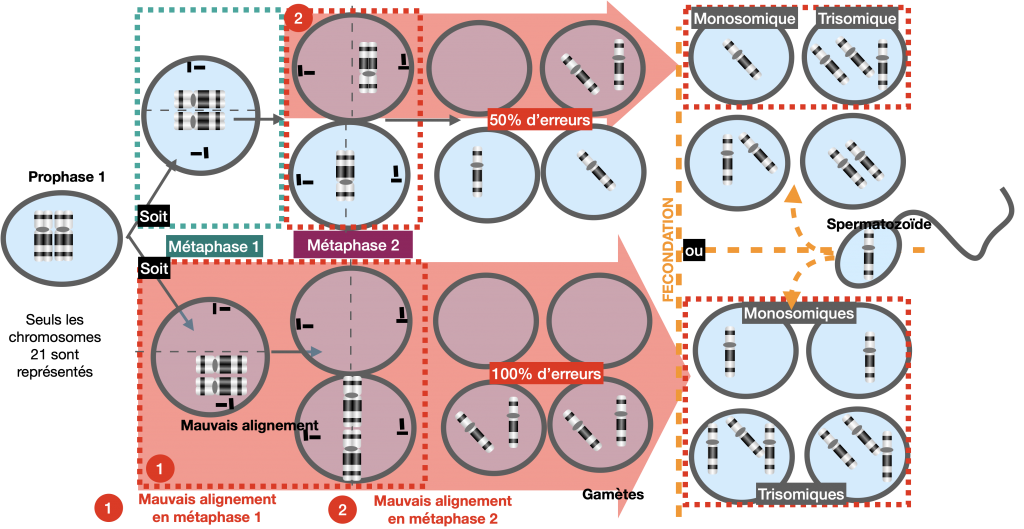
Explication :
Lors de la méiose, la non disjonction des chromosomes homologues en 1ère division ou la non disjonction des 2 chromatides en 2ème division aboutit à la formation de gamètes ayant un caryotype anormal. A l’issue, d’une fusion avec un gamète « normal », la cellule-œuf présente donc un nombre de chromosome anormal : on parle d’aneuploïdie.
Attention dans les explications et les schémas (à savoir refaire) de ne pas oublier la fusion avec un autre gamète !
Doc. 16 : Mécanismes aboutissant à la trisomie.
La plupart des anomalies du caryotype ne sont pas viables (« fausses-couches ») mais si la cellule-œuf se développe, l’individu présentera des troubles importants.
Ex : Syndrome de Down : 3 chromosomes 21 au lieu de 2 (trisomie)
Pour l’exemple de la trisomie 21, cela entraîne un déséquilibre dans le fonctionnement des cellules, en particulier dans le cerveau.
Syndrome de Turner : un seul chromosome sexuel (X) (monosomie)
Il peut exister également des accidents de crossing-over où 2 fragments de longueur différente de chromatides sont échangés.Cet échange de matériel génétique inégal est qualifié de crossing-over inégal.
Dans ce cas, c’est une portion entière de chromosome qui peut être additionnée à un autre, d’où le terme de trisomie partielle. En médecine on parle d’accident de novo. Ces trisomies partielles sont à l’origine de troubles tout aussi important et pour beaucoup non viables ou aux conséquences lourdes.
Doc. 17 : Trisomie partielle
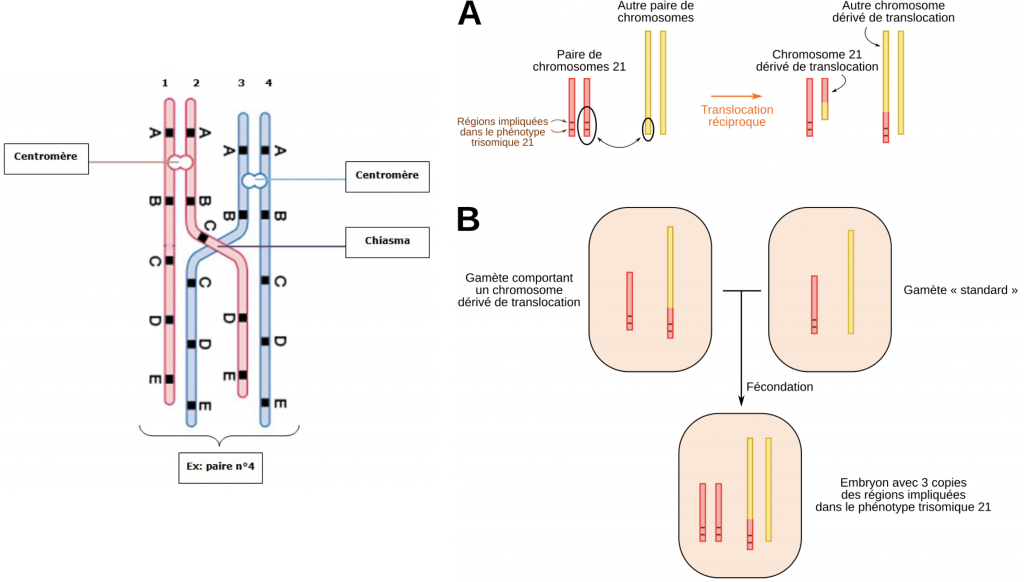
2- Anomalies de méioses et bénéfices : l’origine des familles multigéniques
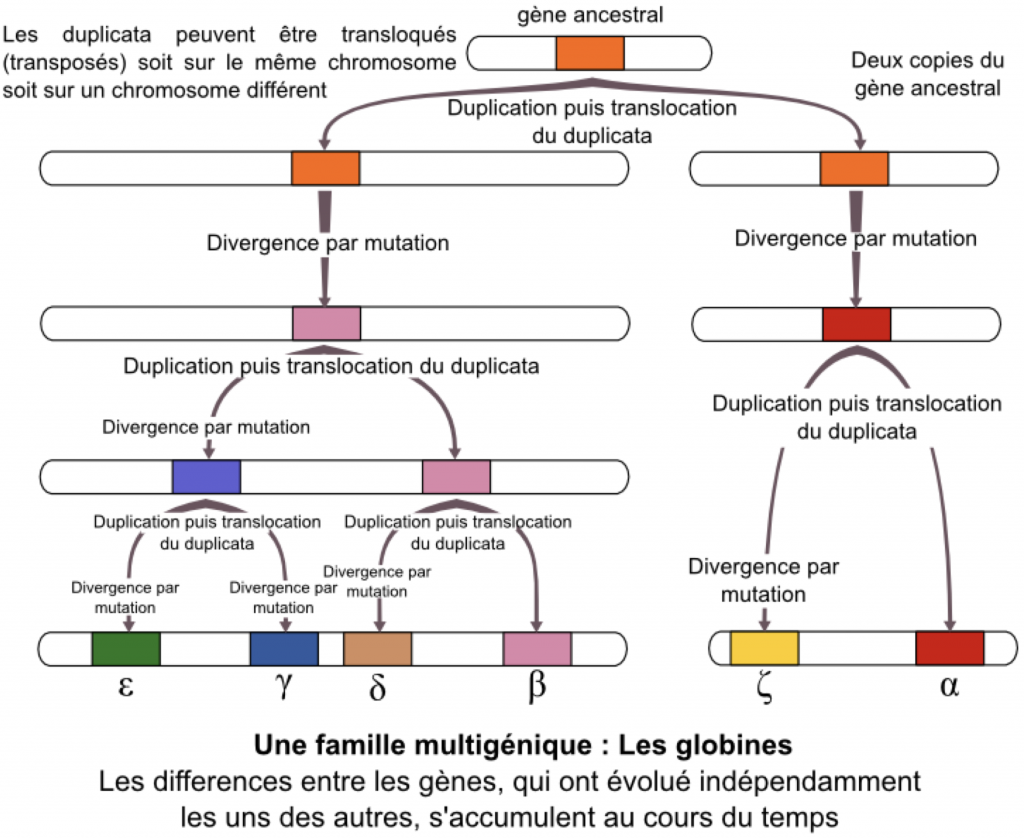
Certains accidents de méiose notamment un crossing-over inégal, peuvent aboutir à la duplication de gènes. Dans ce cas précis, et exceptionnellement, le crossing over inégal n’aboutit qu’à une duplication de gène qui n’a pas de conséquence. Puis, ces duplicatas peuvent devenir différents au fur et à mesure de l’évolution en intégrant une mutation (ou plusieurs) par exemple. Dans ce cas les deux gènes coderont pour des protéines qui auront des fonctions différentes. Les gènes, bien que différents, restent ressemblants, on les qualifie d’homéologues (homologie de séquence très forte). On parle de famille multigénique.
Dans une étude comparative de 2 gènes, si le taux d’identités est supérieur à 20%, alors on conclut à une homologie suffisamment forte entre les 2 gènes pour conclure à une dérive d’un gène ancestral.
C’est par exemple le cas des gènes de l’hémoglobine (transport du O2), ou de la famille des opsines (vision des couleurs)…
Doc. 18 : Les familles multigéniques : exemple des globines
Translocation = soudure d’un fragment chromosomique sur un autre chromosome.
Transposition = changement de locus d’un gène sur le même chromosome
Remarques :
- Les séquences répétées entre les gènes sont à l’origine des mésappariement >5% du génome.
- Chez l’homme : près de 38% des gènes sont apparentés.
Conclusion
La méiose permet un brassage interchromosomique et intrachromosomique au cours des 2 divisions successives permettant la mise en place des gamètes. Ce brassage génétique peut être étudié soit par des croisements classiques de F1 par F1, illustrant les lois génétiques de Mendel. Mais il peut être étudié également à travers des tests cross permettant de mettre en avant si des gènes sont liés ou indépendants.
Des accidents méiotiques engendrent des anomalies chromosomiques ou génétiques souvent délétères s’ils ont des conséquences sur des zones non silencieuses. Mais dans de rares cas, ces anomalies ne sont pas nocives et entraînent l’apparition de nouveaux caractères, par duplication et mutations de gènes (familles multigéniques).
Ainsi, les possibilités de diversité d’individus sont énormes pour ne pas dire quasi infinies si on considère l’ensemble des mécanismes liés à la reproduction sexuée assurant ainsi une possibilité d’évolution dans la nature bien plus grande.
Cependant, les mutations survenant au cours des mitoses successives lors de la croissance /développement des individus , bien que rares, ne doivent pas être négligées car elles engendrent également une diversité génétique qui ne sera transmise aux descendants que si elles ont lieu dans les cellules germinales. Les mutations somatiques provoquent le plus souvent des dysfonctionnements bénins mais peuvent aussi être à l’origine des cancers.


Pour aller plus loin : La thérapie génique d’après l’INSERM

