Les carottes sauvages ont des racines blanchâtres, ligneuses et filandreuses désagréables au goût. De manière empirique ou volontaire, l’Homme a conservé au fil du temps les carottes produisant des pigments de couleur orange en quantité importante, les carotènes, et très peu ligneuses. L’Homme a ainsi domestiqué la carotte.
Il existe actuellement sur le marché, une diversité de variétés de carottes issues de la domestication et sélectionnées par croisements naturels : blanches, rouges, violettes…
Pour une variété de carotte trouvée en magasin, on cherche à savoir si elle possède les mêmes particularités aux échelles anatomique et moléculaire que celles observées chez la carotte orange domestiquée par nos ancêtres.
I – Comparaison de la carotte sauvage et carotte cultivée
Relevez dans un tableau les caractéristiques à différentes échelles (morphologique, moléculaire et génétique) des carottes sauvage et domestiquée que vous différencierez en fonction des échantillons que vous avez (carotte orange, jaune, violette ou panais) et des documents 1 à 8.
Document 1 : Carotte sauvage et carotte cultivée.

Document 2 : Comparaison moléculaire : réaliser une chromatographie
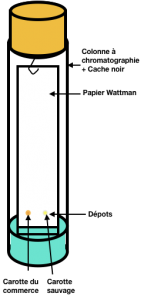
Matériel pour chromatographie :
agitateur,
1 bande de papier Wattman,
règle,
crayon à papier,
crayon à verre ou feutre effaçable,
chronomètre,
1 éprouvette (ou équivalent),
1 bouchon avec crochets de suspension,
1 cache noir pouvant recouvrir l’éprouvette,
solvant à chromatographie
Protocole de dépôt
– Écraser directement une coupe transversale assez fine de racine de carotte sur le papier Wattman avec un agitateur.
– Répéter plusieurs fois l’opération pour obtenir un dépôt bien concentré.
Durée de la migration ascensionnelle : 20 à 30 minutes.
Étant donnée la durée de la migration ne pas hésiter à continuer l’analyse des documents en attendant
Document 3 : Organe racinaire : comparaison anatomique
D’après SNV-jussieu
 Réalisez une coupe fine de la carotte que vous avez sur votre paillasse et comparez la à la loupe binoculaire avec la carotte orange. Relevez ce que vous remarquez en différences. Colorez une section au carmin vert d’iode si possible. Et réalisez en parallèle une coloration à la phloroglucine.
Réalisez une coupe fine de la carotte que vous avez sur votre paillasse et comparez la à la loupe binoculaire avec la carotte orange. Relevez ce que vous remarquez en différences. Colorez une section au carmin vert d’iode si possible. Et réalisez en parallèle une coloration à la phloroglucine.
Protocole de coloration de la lignine :
– Réaliser des coupes fines de carotte d’épaisseur d’environ 2 mm.
– Immerger ces coupes de racines de carotte 15 à 20 minutes dans la solution de phloroglucine
– Les immerger 5 minutes dans l’acide chlorhydrique qui révèle la coloration rouge des tissus lignifiés.
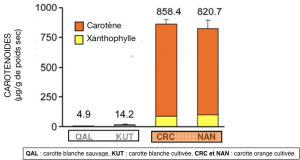
Document 4 : caroténoïdes présents dans la carotte
Document 5 : Filiation supposée des types colorés
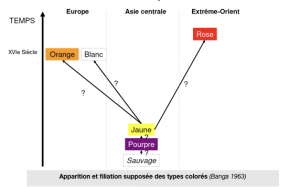
Les Romains consommaient déjà la carotte. Des textes médiévaux permettent de faire le constat d’une consommation de carottes pourpres ou blanches. Mais c’est seulement à la fin du XVIe Siècle que des horticulteurs hollandais arrivent à sélectionner une carotte orange. Cette dernière fait alors son apparition.
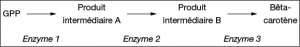
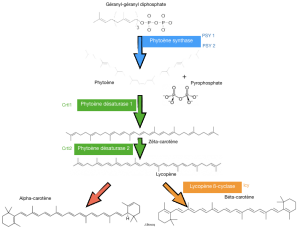
Document 6 : Voie de synthèse du ß-carotène
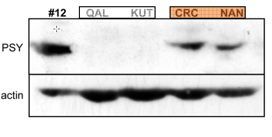
Document 7 : présence de l’enzyme PSY chez différentes carottes (technique appelée western blot)
QAL : carotte blanche sauvage, KUT : carotte blanche cultivée, CRC et NAN : carotte orange cultivée
Document 8 : Taux d’expression des gènes codant pour la synthèse de l’enzyme PSY
Carotte blanche : faibles niveaux d’ARNm pour les gènes PSY1 et PSY2 – absence de l’enzyme PSY
Carotte orange : niveaux élevés d’ARNm pour les gènes PSY1 et PSY2 – présence de l’enzyme PSY
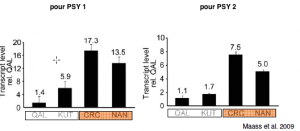
QAL : carotte blanche sauvage, KUT : carotte blanche cultivée, CRC et NAN : carotte orange cultivée
A l’aide des 2 documents suivants, expliquez l’intérêt de connaître les voies de synthèse chez la carotte et son importance dans l’alimentation humaine.
Document 9 : Importance de la vitamine A
L’organisme peut transformer en vitamine A certains caroténoïdes provenant des végétaux. Parmi eux, le bêta-carotène est de loin la provitamine A la plus importante. La vitamine A est un nutriment essentiel au maintien de la santé oculaire. Une carence en vitamine A entraîne une maladie oculaire et peut conduire à la cécité. En fait, le déficit en vitamine A est la plus grande cause évitable de cécité infantile. Les personnes les plus touchées sont les enfants âgés de 6 mois à 6 ans, les femmes enceintes et allaitantes. Une carence en vitamines A est la raison pour laquelle 350 000 enfants perdent la vue chaque année. Environ 140 millions d’enfants originaires de 118 pays différents font des carences en vitamines A. 1/4 des décès infantiles et 30% des cas de cécité dans le monde sont causés par une carence en vitamines A.
Document 10 : Le riz doré
(d’après www.goldenrice.org et annale du bac)
 Le bêta-carotène qui, une fois assimilé dans le corps humain se transforme en vitamine A, existe naturellement dans l’enveloppe du riz mais pas dans sa partie comestible, c’est-à-dire l’albumen. L’enveloppe du riz étant éliminée de manière à améliorer sa conservation, les grains consommés ne contiennent plus de bêta-carotène.
Le bêta-carotène qui, une fois assimilé dans le corps humain se transforme en vitamine A, existe naturellement dans l’enveloppe du riz mais pas dans sa partie comestible, c’est-à-dire l’albumen. L’enveloppe du riz étant éliminée de manière à améliorer sa conservation, les grains consommés ne contiennent plus de bêta-carotène.
Par l’introduction de trois gènes dans du riz, des chercheurs allemands ont réussi à restaurer dans l’albumen une voie de biosynthèse du bêta-carotène à partir de son précurseur : le GPP. Le bêta-carotène alors synthétisé colore les grains en jaune, d’où le surnom de « riz doré ». Cependant, les teneurs obtenues jusqu’à présent ne fourniraient pas aux populations démunies en vitamine A les quantités de bêta-carotène qui leur seraient nécessaires. Mais les effets de carences plus ou moins prononcés pourraient être sensiblement allégés.
Le génome du riz doré contient trois gènes codant la synthèse d’enzymes impliquées dans la chaîne de biosynthèse du bêta-carotène à partir du GPP, à savoir :
- deux gènes de jonquille qui permettent la fabrication des enzymes 1 et 2 ;
- un gène de bactérie qui permet la fabrication de l’enzyme 3