Lors du dernier TP-TD vous avez vu que la diversification des espèces pouvait avoir comme origine différents mécanismes modificateurs du génome, comme la polyploidisation, les transferts horizontaux de gènes ou même la régulation des gènes homéotiques. Et si la diversification des espèces était possible sans modification du génôme ?
Objectifs : Apréhender les notions d’espèces, de diversification et d’évolution.
I- Trois exemples de symbiose : quand deux êtres s’associent par nécessité
A- La symbiose chez les fabacées (d’après : http://svt.ac-noumea.nc)
A l’aide du document 1 2, 3, du polycopié 1 et de la lame de nodosités, montrer qu’associés, ces deux êtres vivants présentent des caractéristiques originales qui apportent des bénéfices qu’ils n’auraient pas s’ils étaient séparés.
Document 1 : Comparaison après un an de culture d’un plant de corroyère du Japon (Coriaria myrtifolia) seule ou en association avec des bactéries du genre Rhizobium
La croissance de plants de soja japonais « inoculés » ou non avec des bactéries du genre «Rhizobium » a été mesurée. La masse totale d azote dans ces plants a également été déterminée. Les résultats figurent dans le tableau ci-dessous.
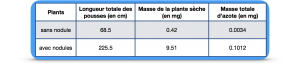
Les bactéries présentes dans les nodosités produisent une protéine, la nitrogénase, capable de transformer l’azote atmosphérique (N2) en une forme utilisable par la plante (ammoniaque : NH3).
Document 2 : Racines de plants de soja cultivés en champ normal (1) ou stérile (2)
Les nodosités sont des renflements présents sur les radicelles, dont le parenchyme central est fait de cellules végétales géantes déformées envahies par des bactéries du genre Rhizobium.
Quand les bactéries sont libres dans le sol, elles ne produisent pas cette protéine.
A votre disposition : une lame mince d’une coupe de nodosité + Polycopié 1 après avoir fini l’observation
Document 3 : Teneur en saccharose marqué radioactivement
Des plants de soja possédant des nodosités ont été cultivés dans un milieu contenant du CO2 dont le C est radioactif (14C). On a ensuite mesuré la radioactivité dans les nodosités.
B- Symbiose entre un champignon et une plante à fleurs : l’efficacité des mycorhizes
90 % des plantes à fleurs (Angiospermes) sont mycorhizées. On distingue des ectomycorhizes et des endomycorhizes. Seules 5% des angiospermes sont concernées par des ectomycorhizes, ce sont les arbres de nos forêts. Par contre la quasi-totalité de nos plantes sont concernées par des endomycorhizes.
- mise en évidence d’endomycorhizes :
A l’aide du protocole ci-dessous réalisez une observation de mycorhize que vous définirez.
• Matériel vivant concerné :
- Les champignons concernés sont des Eumycètes du groupe des Gloméromycètes ou Glomales.
- une plante quelconque, Plantain ou fraisier… Eviter surtout les sols très riches => les plantes ne développent plus de mycorhizes, elles n’en ont pas besoin.
=> Ce sont les racines les plus fines qui sont les plus mycorhizées et donc qui vont nous intéresser
• Produit chimique :
- du bleu coton : bleu de méthyle (Color Index 42780) 1 % et acide acétique 3 %
- de la potasse KOH 10 %
- de l’ eau acidifiée : eau distillée + un peu d’acide chlorhydrique très dilué
Protocole
1. Laver précautionneusement les racines et prendre les plus jeunes, les couper à une longueur de 1-2 cm
2. Les mettre dans un tube à essai avec la potasse 10 %, et chauffer au bain-marie 90° C durant 30 min (on peut optimiser ce temps, parfois 10-15 min suffisent si l’on est pressé et/ou si les racines sont fragiles). Cette opération détruit le contenu des cellules végétales et décolore les tanins des racines ligneuses. La solution devient alors brun-rouge.
3. Jeter la potasse et filtrer dans un tamis, rincer avec l’eau acidifiée pour neutraliser.
4. Remettre dans le bleu coton au bain marie 10 à 15 minutes. Filtrer à nouveau dans un tamis et rincer à l’eau distillée.
5. Pour une observation directe, monter dans l’eau. Si c’est trop épais, écraser doucement avec une gomme carrée (pour ne pas casser la lamelle) ou le doigt.
2) Les échanges entre un arbre et le champignon
D’après les documents suivants, après avoir distingué la différence entre ectomycorhizes et endomycorhizes détaillez les échanges bénéfiques pour le champignon et ceux pour l’arbre.
Document 1 : Différentes mycorhizes
Document 2 : Echanges entre un champignon et une plante mycorhizée
C- Symbiose entre un végétal et un animal : d’après la station biologique de Roscoff
1) Mise en expérience
A marée basse sur les estrans sableux du nord des côtes bretonnes, on peut observer des flaques vertes (1) (de couleur vert-bouteille) comme si on avait des amas de petites algues. Seulement en approchant la main, ce dépôt fuit ou s’agite. En fait il ne s’agit pas d’algues, mais de vers symbiotiques. Ce ver symbiotique s’appelle Ver plat de Roscoff, ou plus précisément Symsagittifera roscoffensis (2). Il a un corps aplati de longueur de 1 à 2 mm de long (4 mm au maximum). Il fut décrit pour la première fois à la station biologique de Roscoff, en 1891. Pourtant il ne s’agit pas d’un ver endémique des côtes bretonnes, puisqu’on le retrouve sur les côtes de la Manche et sur la façade atlantique.
Le Ver de Roscoff est symbiotique d’une algue verte unicellulaire du taxon des prasinophycées : Tetraselmis convolutae (3).
L’interaction qui s’établit entre les deux partenaires est de nature symbiotique puisque chacun en retire un bénéfice :
-
- le ver prélève les produits de la photosynthèse de l’algue (des sucres et des acides aminés essentiels)
- l’algue trouve dans son hôte un milieu stable où elle se trouve protégée des prédateurs du zooplancton.
Ainsi le ver remonte à la surface du sédiment dans une mince pellicule d’eau le recouvrant. Ce comportement remarquable permet d’optimiser la photosynthèse du symbionte, et par là même sa propre nutrition.
Seulement si l’algue séparée de son hôte existe en tant que phytoplancton, le ver dépourvu de son algue n’existe pas.
Problème : Comment démontrer la spécificité de la symbiose ?
- Formuler une hypothèse pour permettre de lancer un test.
- Mettre en route le protocole suivant :
a) Vous disposez d’une plaque partagée par 6 binômes contenant 4 puits pour chaque binôme.
=> numérotez de 1 à 4 vos puits et repérez à l’aide d’initiale votre rangée
b) Puis mettez en culture à l’aide d’un compte goutte des cocons de vers de Roscoff et de l’eau de mer stérile de telle façon à ce que le puit soit rempli au 2/3
c) rajoutez 3 à 4 gouttes dans chaque puit les algues suivantes :
Un témoin sera mis dans de l’eau de mer stérile en dehors des puits.
Résultats à compléter la semaine suivante :
Cycle du ver de Roscoff :
Vidéo de cocons et de juvéniles non symbiotiques
Interprétez les résultats obtenus.
2) Les échanges du ver de Roscoff
Qu’est ce que cette symbiose a de remarquable ?
Au même titre que vous l’avez réalisez dans le TP précédent pour les différents mécanismes de diversification, complétez le schéma général de la diversification spécifique par symbiose :
II- Les mécanismes permettant une évolution de la diversité des populations au cours du temps
Vous pouvez réaliser les activités 1 à 4 de votre livre pages 56 à 63. Cette partie fera aussi l’objet d’une séance particulière en AP (Battle de QCM). Si vous devez privilégier 2 activités en particulier, il s’agit de la 1 et de la 4. Cependant les exemples ne manquent pas et regardez bien ce que l’on peut vous demander.